Chloralkali-Elektrolyse

Eine Fabrikhalle zur Herstellung von Natronlauge und Chlor als Basis für Polyvinylchlorid im Sag-Betriebe Buna in Schkopau 1953
Mit der Chloralkali-Elektrolyse werden die wichtigen Grundchemikalien Chlor, Wasserstoff und Natronlauge aus Natriumchlorid und Wasser erzeugt. Der Begriff steht allgemein für die Herstellung mittels Elektrolyse, unabhängig davon, welche der Techniken verwendet wird. Mittels Elektrolyse können auch andere Metallsalze (Chloride von Alkalimetallen, Erdalkalimetallen und viele mehr) zu ihren Hydroxiden umgesetzt werden. Verwendet man beispielsweise Kaliumchlorid anstatt von Natriumchlorid, erhält man Kalilauge. Die Chloralkali-Elektrolyse ist eine endotherme Reaktion. Die benötigte Energie von 454 kJ/mol wird in Form von elektrischem Strom zugeführt. Da Natronlauge, Chlor wie andere Grundchemikalien im Maßstab von Millionen Tonnen jährlich benötigt werden, ist die Elektrolyse enorm energieaufwendig. Wasserstoff als Produkt ist zwar ebenso wichtig, jedoch wird das Verfahren hauptsächlich für die Gewinnung von Chlor und Natronlauge verwendet. Moderne Verfahren verhindern die Reduktion von Wasser zu Wasserstoff und sparen somit beachtliche Mengen an Energie. In allen Verfahren wird versucht, das Chlorgas vom Hydroxid zu trennen, um eine Disproportionierung von Chlor zu Chlorid und Hypochlorit zu vermeiden, was die Natronlauge verunreinigen würde. Die gewonnenen Mengen an Natronlauge werden oft eingedampft, um festes Natriumhydroxid zu erhalten.
Inhaltsverzeichnis
1 Geschichte
2 Grundlagen
3 Technische Verfahren
3.1 Diaphragmaverfahren
3.2 Membranverfahren
3.3 Amalgamverfahren
3.4 Sauerstoffverzehrkathode (SVK)
4 Vergleich der Methoden
5 Weltproduktion und Anteile an den Verfahren
6 Siehe auch
7 Literatur
8 Weblinks
9 Quellen
Geschichte |
Die drei Verfahren zur technischen Herstellung von Chlor und Natron-, Kalilauge waren am Ende des 19. Jahrhunderts das Diaphragmaverfahren, das Glockenverfahren und das Amalgamverfahren.[1]
Das Diaphragmaverfahren wurde von Breuer im Jahr 1885 entwickelt. Ignatz Stroof und die Gebrüder Lang bauten bei der Chemischen Fabrik Elektron in Griesheim 1890 die erste größere Anlage zur Gewinnung von Natronlauge und Chlor mittels des Diaphragmaverfahrens. Im Jahr 1898 wurde die Gesellschaft Griesheim-Elektron gegründet. Es entstanden drei große Werke in Deutschland, und zwar in Griesheim, Bitterfeld und Greppin,[2] sowie mehrere Werke im europäischen Ausland (Spanien, Frankreich, Russland).
In Frankreich wurde ein abgeändertes Diaphragma-Verfahren von Outhenin, Chalandres ausgearbeitet. Jedoch musste der Betrieb bald eingestellt werden.
Das Amalgamverfahren ist auch als Castner-Kellner-Verfahren (Natriumhydroxid) bekannt und wurde in den 1890er Jahren durch Hamilton Castner in England und Karl Kellner in Österreich erfunden. Es fand große industrielle Bedeutung, wurde aber in den 1970er Jahren aus Umweltschutzgründen größtenteils aufgegeben.
Da neben Natron- und Kalilauge auch immer Chlor im entsprechenden Anteil mitproduziert wurde, war die chemische Industrie schon früh daran interessiert, Marktanwendungen für das reichliche Chlor zu finden.
Im Ersten Weltkrieg wurde ein Teil des Chlors zur Herstellung von Kampfgasen verwendet. Zwischen 1950 und 1960 wurden viele giftige und biologisch schwer abbaubare organische Chlorverbindungen wie PCB oder DDT hergestellt.
Henri Bernard Beer entwickelte 1963 die formbeständige oxidbeschichtete Titan-Anode für das Diaphragmaverfahren.
In den 70er Jahren wurde in Japan das modernere Membranverfahren als Reaktion auf die Minamata/Niigata-Krankheit entwickelt, welche durch eine chronische Quecksilbervergiftung verursacht worden war.
Grundlagen |
Das zu verarbeitende Salz wird in Wasser gelöst als „Sole“ zugeführt:
- NaCl(s)⇌Na(aq)++Cl(aq)−{displaystyle mathrm {NaCl_{(s)}rightleftharpoons Na_{(aq)}^{+}+Cl_{(aq)}^{-}} }
Aufgrund der Autoprotolyse des Wassers bilden sich stets H3O+ (Oxonium-Kationen) und OH− (Hydroxid-Anionen) in der Lösung:
- H2O(l)+H2O(l)⇌H3O(aq)++OH(aq)−{displaystyle mathrm {H_{2}O_{(l)}+H_{2}O_{(l)}rightleftharpoons H_{3}O_{(aq)}^{+}+OH_{(aq)}^{-}} }
Legt man an den Elektroden eine Spannung an, wird Arbeit an der Zelle verrichtet.
Es handelt sich um eine Elektrolysezelle.
Es werden bevorzugt die Ionen oxidiert, welche das geringste Zersetzungspotential haben.
Thermodynamisch begründen kann man dies mit der Freien Enthalpie:
- ΔG0=−zFE0{displaystyle Delta G^{0}=-zFE^{0}}
wobei F die Faraday-Konstante, z{displaystyle z} die Anzahl der übertragenen Elektronen und E{displaystyle E} das Standardreduktionspotential der Reaktion ist. Wird der Wert der Freien Enthalpie kleiner Null, dann läuft die Reaktion freiwillig ab (exergonische Reaktion). Ist der Wert größer Null läuft Sie nicht freiwillig ab (endergonische Reaktion).
Für Chlor ergibt sich nach konventioneller Reaktion (als Reduktionsgleichung) ein Standardpotential von +1,36 Volt.
- Cl2+2e−→2Cl(aq)− E0=+1,36V{displaystyle mathrm {Cl_{2}+2e^{-}rightarrow 2Cl_{(aq)}^{-}} E^{0}=+1{,}36,mathrm {V} }
da aber eine Oxidation stattfinden soll und keine Reduktion, ist das Vorzeichen des Standardpotentials der Reaktion umgedreht:
- 2Cl(aq)−→Cl2+2e− E0=−1,36V{displaystyle mathrm {2Cl_{(aq)}^{-}rightarrow Cl_{2}+2e^{-}} E^{0}=-1{,}36,mathrm {V} }
daraus ergibt sich für die Freie Enthalpie:
ΔG=−2⋅96485 Cmol⋅(−1,36 V)=262,439 kJmol>0{displaystyle Delta G=-2cdot 96485 mathrm {{frac {C}{mol}}cdot (-1{,}36 mathrm {V} )=262{,}439 {frac {kJ}{mol}}>0} }.
Die Oxidation verläuft also unfreiwillig, es handelt sich um eine endergonische Reaktion:
Bei günstiger Wahl der Elektrodenmaterialien sind dies die Chlorid-, die oxidiert werden, und die Oxonium-Ionen, die reduziert werden. Zurück bleiben die Natrium- und die Hydroxidionen, die die Natronlauge bilden.
- Kathodenreaktion
4H2O→2H3O++2OH−{displaystyle mathrm {4,H_{2}Orightarrow 2,H_{3}O^{+}+2,OH^{-}} }
Dissoziation des Wassers
2H3O++2e−→H2+2H2O{displaystyle mathrm {2,H_{3}O^{+}+2,e^{-}rightarrow H_{2}+2,H_{2}O} }
Kathodenreaktion
2H2O+2e−→H2+2OH−{displaystyle mathrm {2,H_{2}O+2,e^{-}rightarrow H_{2}+2,OH^{-}} }
Gesamtreaktion im Kathodenraum
- Anodenreaktion
2Cl−→Cl2+2e−{displaystyle mathrm {2,Cl^{-}rightarrow Cl_{2}+2,e^{-}} }
Anodenreaktion
2NaCl→2Na++Cl2+2e−{displaystyle mathrm {2,NaClrightarrow 2,Na^{+}+Cl_{2}+2,e^{-}} }
Gesamtreaktion im Anodenraum
- Gesamtreaktion
- 2NaCl+2H2O→2NaOH+Cl2+H2{displaystyle mathrm {2,NaCl+2,H_{2}Orightarrow 2,NaOH+Cl_{2}+H_{2}} }
Für die technische Umsetzung ist es wichtig, dass das entstandene Chlor nicht in Kontakt mit den Hydroxid-Ionen kommt, welches zu Chlorid und Hypochlorit disproportionieren würde und das Produkt so verunreinigt:
- Cl2+2OH−→Cl−+OCl−+H2O{displaystyle mathrm {Cl_{2}+2,OH^{-}rightarrow Cl^{-}+OCl^{-}+H_{2}O} }
Außerdem muss darauf geachtet werden, dass sich das Chlorgas nicht mit dem Wasserstoffgas vermischt, da so Chlorknallgas entstehen würde.
Diese Anforderungen werden von allen folgenden Verfahren erfüllt.
Technische Verfahren |
Diaphragmaverfahren |
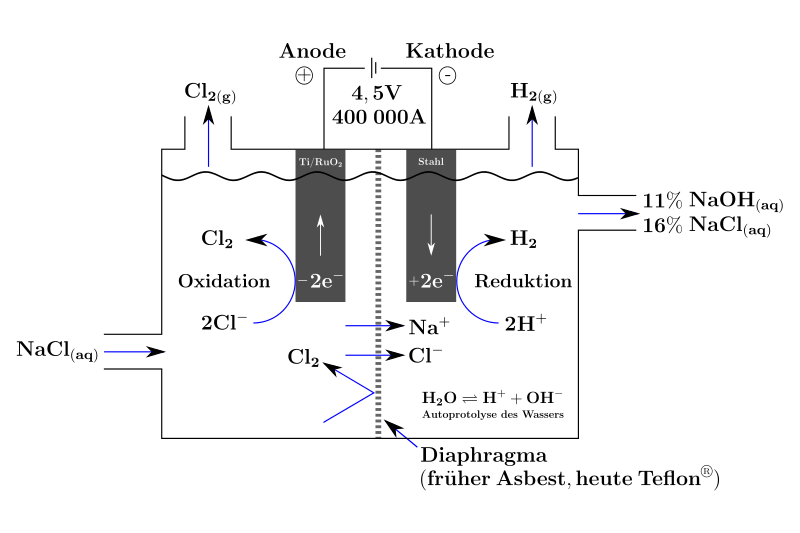
Beim Diaphragmaverfahren besteht die Kathode aus Stahl oder mit Nickel beschichtetem Stahl, die Anode aus mit Ruthenium(IV)-oxid beschichtetem Titan.[3] Der Kathodenraum ist vom Anodenraum durch eine strom- und kationendurchlässige, poröse Trennwand abgegrenzt, damit das an der Anode gebildete Chlor weder mit dem an der Kathode gebildeten Wasserstoff, noch den ebenfalls gebildeten Hydroxid-Ionen in Kontakt kommt. Chlor würde sonst mit den OH− Ionen zu Cl− und OCl−disproportionieren.
Cl2+2OH−→Cl−+OCl−+H2O{displaystyle mathrm {Cl_{2}+2,OH^{-}rightarrow Cl^{-}+OCl^{-}+H_{2}O} }
Das Redoxpaar H2/H3O+ hat ein höheres Potential als Na/Na+, zudem ist die Überspannung des Wasserstoffes am Eisen nicht sehr groß, deshalb entwickelt sich an der Kathode Wasserstoff und nicht Natrium. Durch die Entladung der Oxonium-Ionen an der Kathode ist die Lösung im Kathodenraum basisch. An der Anode werden wegen der Überspannung des Sauerstoffes am Titan die Cl− Ionen entladen.
Anode: 2Cl−(aq)→Cl2(g)+2e−{displaystyle mathrm {2,Cl^{-}(aq)rightarrow Cl_{2}(g)+2,e^{-}} }
Kathode: H3O+(aq)+2e−→OH−(aq)+H2(g){displaystyle mathrm {H_{3}O^{+}(aq)+2,e^{-}rightarrow OH^{-}(aq)+H_{2}(g)} }
Das Diaphragma besteht meist aus Asbest. Heute werden auch Diaphragmen aus Polytetrafluorethylen und anorganischen Zusatzstoffen eingesetzt. Da das Diaphragma die in der Lösung vorhanden Hydroxid-Ionen nicht vollständig am Eindringen in den Anodenraum hindern kann, ist bei einer erhöhten Hydroxid-Ionenkonzentration eine Reaktion zu Wasser und Sauerstoff möglich. Daher kann nur eine Natronlauge bis zu einer Konzentration von etwa 12–15 % gewonnen werden.
Nach dem Sprachgebrauch der EU stellt die Verwendung von Asbest nicht die beste verfügbare Technik dar.
Membranverfahren |

Das Membranverfahren arbeitet mit einer Titananode und einer Nickelkathode. Der entscheidende Unterschied zum Diaphragmaverfahren besteht darin, dass beim Membranverfahren eine etwa 0,1 mm dünne chlorbeständige Kationentauschermembran, welche aus Polytetrafluorethylen (PTFE/Teflon) mit negativ geladenen SO3-Resten besteht (Nafion), das Diaphragma ersetzt. Die Anionen wie OH− oder Cl− können sie nicht passieren, wohingegen die positiv geladenen Na+-Ionen hindurch gelangen. Aufgrund der Undurchlässigkeit für Cl−-Ionen entsteht eine kaum durch Natriumchlorid verunreinigte 30-33 %ige Natronlauge. Die chemischen Vorgänge an den Elektroden entsprechen denen beim Diaphragmaverfahren.
Anode (Plus-Pol): 2Cl−(aq)→Cl2(g)+2e−{displaystyle mathrm {2,Cl^{-}(aq)rightarrow Cl_{2}(g)+2,e^{-}} }
Kathode (Minus-Pol): H3O+(aq)+2e−→OH−(aq)+H2(g){displaystyle mathrm {H_{3}O^{+}(aq)+2,e^{-}rightarrow OH^{-}(aq)+H_{2}(g)} }
Dieses Verfahren, welches das neuste der hier dargestellten ist, findet heutzutage in etwa 2/3 der großtechnisch arbeitenden Betriebe Verwendung, da dabei die Endprodukte Cl2, H2 und NaOH fast in der gleichen Reinheit anfallen wie beim Amalgamverfahren, jedoch insgesamt ein deutlich geringerer Energieeinsatz erforderlich ist. Weiterhin kann vollständig auf den Gebrauch des unter Umweltaspekten umstrittenen Quecksilbers verzichtet werden.
Amalgamverfahren |

Die Elektrolyse von Natriumchlorid-Lösung erfolgt beim Amalgam-Verfahren zwischen einer Titan-Anode und der namensgebenden Quecksilber-Kathode. Bis Anfang der 70er Jahre wurden Graphit-Anoden verwendet, die jedoch deutlich niedrigere Standzeiten als die modernen Titan-Anoden aufwiesen. An der Anode wird Chlorgas abgeschieden. Das an der Kathode gebildete Natrium löst sich sofort in dem Quecksilber als Natriumamalgam. Das Amalgam wird danach mit Wasser unter Graphit-Katalyse zersetzt, worauf sich Natriumhydroxid und Wasserstoff bilden. Das verbleibende Quecksilber wird in den Prozess zurückgeführt.
Die Abscheidung von Chlor und Natrium an den Elektroden beruht auf der Verschiebung der Abscheidungspotentiale der Elemente Wasserstoff und Sauerstoff aufgrund von Überspannungen.
Theoretisch könnten folgende Elektrodenreaktionen ablaufen:
Anoden-Reaktion (Oxidation):
- 2 Cl−(aq) →Cl2(g)+2 e−E0=+1,36V4 OH−(aq) →O2(g)+2 H2O+4 e−E0=+0,40V{displaystyle {begin{alignedat}{3}&mathrm {2 Cl^{-}(aq)} &&rightarrow mathrm {Cl_{2}(g)+2 e^{-}} quad &&E^{0}=+1{,}36,mathrm {V} \&mathrm {4 OH^{-}(aq)} &&rightarrow mathrm {O_{2}(g)+2 H_{2}O+4 e^{-}} quad &&E^{0}=+0{,}40,mathrm {V} end{alignedat}}}
Kathoden-Reaktion (Reduktion):
- Na+(aq)+e− →NaE0=−2,71V2 H3O+(aq)+2 e− →H2+2 H2OE0=+0,00V{displaystyle {begin{alignedat}{3}&mathrm {Na^{+}(aq)+e^{-}} &&rightarrow mathrm {Na} quad &&E^{0}=-2{,}71,mathrm {V} \&mathrm {2 H_{3}O^{+}(aq)+2 e^{-}} &&rightarrow mathrm {H_{2}+2 H_{2}O} quad &&E^{0}=+0{,}00,mathrm {V} end{alignedat}}}
Demnach müssten Wasserstoff und Sauerstoff abgeschieden werden. Durch die Wahl des geeigneten Elektrodenmaterials (Titan-Anode und Quecksilber-Kathode) und der richtigen Konzentrationsverhältnisse kommt es jedoch zur Abscheidung von Natrium und Chlor.

Das Natrium reagiert an der Quecksilber-Kathode sofort zu Natriumamalgam: Na⋅Hgx{displaystyle mathrm {Nacdot Hg_{x}} }
Zur Gewinnung von Natronlauge wird das Natriumamalgam im Amalgamzersetzer mit Wasser zur Reaktion gebracht.
Zersetzungsreaktion:
- 2 Na⋅Hgx+2 H2O→2 NaOH(aq)+H2(g)+2x Hg{displaystyle mathrm {2 Nacdot Hg_{x}+2 H_{2}Orightarrow 2 NaOH(aq)+H_{2}(g)+2x Hg} }
Gesamt-Reaktion:
- 2 NaCl(aq)+2 H2O→2 NaOH(aq)+Cl2(g)+H2(g){displaystyle mathrm {2 NaCl(aq)+2 H_{2}Orightarrow 2 NaOH(aq)+Cl_{2}(g)+H_{2}(g)} }
Auf Grund der Quecksilberemissionen und des hohen Stromverbrauchs wird das Amalgamverfahren weltweit immer mehr durch das Membranverfahren ersetzt. In der Europäischen Union gilt das Amalgamverfahren unter keinen Umständen als beste verfügbare Technik. Gemäß der Minamata-Konvention soll die Verwendung des Amalgamverfahrens weltweit bis 2025 auslaufen, wobei unter bestimmten Bedingungen Ausnahmen möglich sind.
Sauerstoffverzehrkathode (SVK) |

Die Sauerstoffverzehrkathode (SVK, Englisch ODC für „oxygen depolarised cathodes“) wurde um die Jahrtausendwende von Bayer MaterialScience entwickelt und wird seitdem von ThyssenKrupp Uhde/Uhdenora international vertrieben.[4] Das Verfahren zeichnet sich vor allem durch den reduzierten Stromverbrauch aus.[5] Außerdem wird das Vorhaben vom Bundesministerium für Bildung und Forschung gefördert.[6]
Bei der Chlorelektrolyse mit Sauerstoffverzehrkathode wird grundsätzlich dieselbe Elektrolysezelle verwendet wie beim Membranverfahren, nur dass die herkömmliche Kathode durch eine solche mit einer speziellen Sauerstoffdiffusions-Oberfläche ersetzt wird. Hinter diese wird Sauerstoff eingeleitet. Der Sauerstoff wird zusammen mit Wasser zu Hydroxidionen reduziert:[7]
Kathode (Reduktion): O2(g) + 2 H2O(l)+ 4 e−→ 4 OH(aq)−{displaystyle mathrm {{O_{2}}_{(g)} + {2 H_{2}O}_{(l)}+ 4 e^{-}rightarrow 4 OH_{(aq)}^{-}} }
Anode (Oxidation): 4 Cl(aq)− → 2 Cl2(g) + 4 e−{displaystyle mathrm {4 Cl_{(aq)}^{-} rightarrow 2 Cl_{2(g)} + 4 e^{-}} }
Gesamtreaktion: 4 NaCl+ 2 H2O + O2 → 4 NaOH + 2 Cl2{displaystyle mathrm {4 NaCl+ 2 H_{2}O + O_{2} rightarrow 4 NaOH + 2 Cl_{2}} }
Die Hydroxidionen der Natronlauge stammen nun aus mit Wasser reduziertem Sauerstoff und nicht mehr aus der Autoprotolyse des Wassers. Folglich werden auch keine Protonen mehr zu Wasserstoffgas reduziert. Dadurch kann die Betriebsspannung der Zelle deutlich abgesenkt werden: Statt 3 Volt werden nur noch 2 Volt benötigt.[8] Zwar verliert man damit das Nebenprodukt Wasserstoff, der aber auf direktem chemischen Weg effizienter hergestellt werden kann als durch die Elektrolyse, da die typischen Verstromungsverluste von 50 bis 65 % der Ausgangsenergie vermieden werden.
Bei bis zu 450.000 A pro Zelle benötigt die Chlorelektrolyse erhebliche Mengen an Strom. Durch die reduzierte Betriebsspannung ist mit der Sauerstoffverzehrkathode eine enorme Energieeinsparung möglich.[8] Nach Aussage von Tony Van Osselaer (ehemaliges Vorstandsmitglied von Bayer MaterialsScience) ließe sich der Strombedarf Deutschlands um 1 % reduzieren, würden alle in der Chloralkalisynthese tätigen Firmen auf die SVK-Technik umstellen.[4] Da dies mit Investitionen verbunden ist, wird die Umstellung von älteren Techniken noch vielerorts aufgeschoben.
Die SVK ist ein sehr gutes Beispiel für die Weiterentwicklung eines Verfahrens, dessen Entwicklung eigentlich schon als „abgeschlossen“ beurteilt wurde.
Die Chloridionen können auch aus anderen Quellen als Natriumchlorid (Kochsalz) stammen, z. B. aus Salzsäure als Abfallprodukt der Herstellung von Polyurethanen.[9]
Vergleich der Methoden |
Da die Chloralkalielektrolyse sehr viel elektrische Energie benötigt ist sie sehr teuer. Außerdem müssen Firmen die in dieser Industrie tätig sind auch an umweltliche Auswirkungen denken. Auch muss sich am Stand der Technik orientiert werden um herauszufinden, welches Verfahren die Beste verfügbare Technik darstellt.
| Methode | Vorteile | Nachteile |
|---|---|---|
| Diaphragmaverfahren |
|
|
| Membranverfahren |
|
|
| Amalgamverfahren |
|
|
| Sauerstoffverzehrkathode |
|
|
Weltproduktion und Anteile an den Verfahren |
Die weltweite Produktionskapazität von Chlor lag 2012 bei ca. 77 Mio. t/a. Den größten Anteil daran hatte China mit etwa 40 %; die Europäische Union hatte einen Anteil von etwa 16 %. Die Chlorproduktion in der Europäischen Union betrug im Jahr 2013 rund 9,5 Mio t, Deutschland hat hierbei einen Anteil von etwa 40 %. Der größte europäische Hersteller mit fast 20 % Anteil ist Dow Chemical in Stade und Schkopau.
Die Anteile an den Herstellungsverfahren waren 1990 weltweit 39 % Amalgam-, 45 % Diaphragma- und 16 % Membran-Verfahren.[11] In den Vereinigten Staaten war traditionell das Diaphragmaverfahren am stärksten vorherrschend (67 % Marktanteil 2003), in Westeuropa das Amalgamverfahren und in Japan aufgrund der frühen Einführung dort das Membranverfahren. In Japan wurde 2005 bereits ausschließlich nach dem Membranverfahren produziert.[1]
In der EU ist der Anteil des Membranverfahrens inzwischen (2014) auf über 60 % angewachsen.
Siehe auch |
- Liste von Chloralkali-Elektrolyseanlagen
Literatur |
- F. R. Minz, R. Schliebs: Moderne Verfahren der Großchemie: Chlor und Natronlauge. In: Chemie in unserer Zeit. 12. Jahrg. 1978, Nr. 5, S. 135–145.
- Peter Schmittinger (Hrsg.): Chlorine: Principles & Industrial Practice. Wiley, 2008, ISBN 978-3-527-61339-7.
Weblinks |
zu Besten verfügbaren Techniken bei der Herstellung von Chlor-alkali
European IPPC Bureau: BAT Reference Document for the Production of Chlor-alkali (5,3 MB)
zu Produktion, Kapazitäten und Standorten der Chlorherstellung in der Europäischen Union:
- Euro Chlor: Chlorine Industry Review 2014-2015
Quellen |
↑ abcde Thomas F. O’Brien: History of the Chlor-Alkali Industry (2005)
↑ Wolfgang Metternich, Von den frühen Tagen der chemischen Industrie zum Industriepark Griesheim: 150 Jahre Chemie in Griesheim, Festschrift, Industriepark Griesheim, Frankfurt am Main 2006.
↑ Eintrag zu Ruthenium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. April 2011.
↑ ab Neues Verfahren senkt Energieverbrauch bei Chlor-Produktion um 30 %. In: Process. 14. Juni 2013, abgerufen am 2. Juni 2016.
↑ GDCH-Wochenschau: „Energie sparen durch Effizienz - Erfolge in der Chemie“
↑ Effizient zum grünen Gas – chemietechnik.de. In: chemietechnik.de. Abgerufen am 2. Juni 2016.
↑ Imad Moussallem, Jakob Jörissen, Ulrich Kunz, Stefan Pinnow, Thomas Turek: Chlor-alkali electrolysis with oxygen depolarized cathodes: history, present status and future prospects. In: Journal of Applied Electrochemistry. Band 38, Nr. 9, 14. Mai 2008, S. 1177–1194, doi:10.1007/s10800-008-9556-9.
↑ ab bayer.de: Sauerstoffverzehrkathode (Link ist tot)
↑ Bayer erhält Umweltpreis für Sauerstoffverzehrkathoden-Technologie. In: Process. 24. Juni 2008, abgerufen am 2. Juni 2016.
↑ „Reduktion der Hg-Emission um über eine Zehnerpotenz bis auf 20 g pro Tonne Chlor im Jahre 1979“ (Holleman-Wiberg)
heute: 0,68 g Hg/t Chlor (2013, Eurochlor)
↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 436.
























