Malaria
| Klassifikation nach ICD-10 | ||
|---|---|---|
| B50 | Malaria tropica durch Plasmodium falciparum | |
| B51 | Malaria tertiana durch Plasmodium vivax | |
| B52 | Malaria quartana durch Plasmodium malariae | |
| B53 | Sonstige parasitologisch bestätigte Malaria | |
| B54 | Malaria, nicht näher bezeichnet | |
ICD-10 online (WHO-Version 2019) | ||
Malaria – auch Sumpffieber, Wechselfieber, Marschenfieber, Febris intermittens, Kaltes Fieber oder veraltet Akklimatisationsfieber,[1]Klimafieber,[1]Küstenfieber,[1]Tropenfieber[1] genannt – ist eine Infektionskrankheit, die von einzelligen Parasiten der Gattung Plasmodium hervorgerufen wird. Sie wird heutzutage hauptsächlich in den Tropen und Subtropen durch den Stich einer weiblichen Stechmücke (Moskito) der Gattung Anopheles übertragen. Außerhalb dieser Gebiete lösen gelegentlich durch den Luftverkehr eingeschleppte Moskitos die sogenannte „Flughafen-Malaria“ aus. Hierbei sind alle Personen im direkten Umfeld von Flughäfen gefährdet, z. B. Flughafenbedienstete oder Anwohner. Bis auf eine Übertragung durch Bluttransfusion und Laborunfälle ist eine Mensch-zu-Mensch-Ansteckung nur gelegentlich von der Mutter auf das ungeborene Kind möglich, wenn die Plazenta (besonders während der Geburt) verletzt wird. Der Mensch und die Anopheles-Mücken stellen das einzige nennenswerte Erregerreservoir humanpathogener Plasmodien dar.
Die Malaria ist mit etwa 200 Millionen Erkrankten pro Jahr die häufigste Infektionskrankheit der Welt.[2] Mit wissenschaftlichen Computermodellen wurden für das Jahr 2010 rund 1,2 Millionen Todesfälle aufgrund einer Malariainfektion errechnet, nachdem Daten von 1980 bis 2010 gesammelt worden waren. Den Modellen nach erreichte die Zahl der Malariatoten im Jahr 2004 mit 1,8 Millionen einen Höhepunkt.[3]
Früher galten nur vier Erreger als humanpathogen: Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale und Plasmodium malariae. Mittlerweile ist bekannt, dass ein weiterer Stamm aus Südostasien, der bislang hauptsächlich als für Makaken gefährlich galt, auch in größerer Zahl als bislang angenommen den Menschen infizieren kann: Plasmodium knowlesi.[4][5]
Hinsichtlich ihres Krankheitsverlaufes und ihrer geographischen Verbreitung unterscheiden sich die Erreger erheblich. Plasmodium falciparum ist der klinisch bedeutsamste und bedrohlichste Erreger.
Die Symptome der Malaria sind hohes, wiederkehrendes bis periodisches (Wechsel-)Fieber, Schüttelfrost, Beschwerden des Magen-Darm-Trakts und Krämpfe. Besonders bei Kindern kann die Krankheit rasch zu Koma und Tod führen.
In Deutschland besteht nach § 7 Abs. 3 Infektionsschutzgesetz (IfSG) eine nichtnamentliche Meldepflicht des direkten Nachweises des Krankheitserregers.[6]
Inhaltsverzeichnis
1 Wortherkunft
2 Epidemiologie
2.1 Geographische Verteilung
2.2 Genetische Mutationen und Bedeutung der Malaria in der Menschheitsgeschichte
2.3 Jährliche Opfer und Inzidenz
3 Erreger
3.1 Liste humanpathogener Erreger
3.2 Lebenszyklus
3.2.1 Im Menschen (asexuelle Phase/Schizogonie)
3.2.2 In der Mücke (sexuelle Phase/Sporogonie)
3.3 Infektionswege Mensch zu Mensch
4 Pathogenese
4.1 Plasmodium falciparum
4.2 Übrige Plasmodien
5 Klinisches Bild, Symptomatik
5.1 Malaria tropica
5.1.1 Inkubationszeit
5.1.2 Fieber
5.1.3 Neurologische Komplikationen
5.1.4 Anämie
5.1.5 Hämoglobinurie
5.1.6 Veränderungen anderer Organsysteme
5.2 Malaria tertiana
5.2.1 Inkubationszeit
5.2.2 Fieber
5.3 Malaria quartana
5.3.1 Inkubationszeit
5.3.2 Fieber
5.3.3 Nierenbeteiligung
5.4 Rezidive
6 Diagnostik
7 Vorbeugung und Behandlung
7.1 Impfung
7.2 Insektenschutz
7.3 Chemoprophylaxe und Therapie
7.4 Vektorkontrolle
8 Forschung
8.1 Therapieansätze
8.2 Verteiltes Rechnen
8.3 Körpergeruch bei Erkrankten
9 Armutsbedingte Krankheit
10 Volkswirtschaftliche Auswirkung
11 Geschichte
12 Siehe auch
13 Literatur
13.1 Leitlinien
13.2 Deutschsprachige Bücher
13.3 Hochschulschriften
13.4 Englischsprachige Bücher
13.5 Zeitschriften-Beiträge und Buch-Artikel
14 Weblinks
15 Einzelnachweise
Wortherkunft |
Der Krankheitsname Malaria ist abgeleitet von italienisch mal'aria[7] („schlechte Luft“, die insbesondere aus den Sümpfen steigt und seit der Antike als krankheitsverursachend, insbesondere beim Wechselfieber (Febris intermittens), gehalten wurde[8]), von lateinisch mala „schlecht“, und aer „Luft“. Der italienische Ausdruck mal(a) aria findet sich 1709 in einem diese Erkrankung umfangreich behandelnden Werk des Mediziners Francesco Torti (1658–1741), einem Leibarzt von Francesco II. d’Este und Rinaldo d’Este.[9][10]

Die Stechmücke Anopheles bei der Blutmahlzeit
Epidemiologie |
Geographische Verteilung |
Die geographische Verteilung der Malaria (siehe Karte 2005 – aktuelle Karte bei der DTG, Weblinks) ähnelt im 21. Jahrhundert der Temperaturverteilung der Erde. Die als Überträger geeigneten Anophelesarten kommen jedoch auf allen Kontinenten (außer der Antarktis) vor, wobei das Verbreitungsgebiet der Anopheles-Mücke auf niedrige Meereshöhen (unter 2500 m am Äquator und unter 1500 m in den restlichen Regionen) begrenzt ist. Die globale Erwärmung hat auch einen Einfluss auf die Verbreitung der Malaria, beispielsweise in höher gelegenen Regionen. Das Ausmaß dieses Einflusses ist jedoch umstritten.[11][12] Malaria war insbesondere gegen Ende des Zweiten Weltkriegs bis in den Norden Europas und Nordamerikas verbreitet. Das Risiko in den einzelnen Endemiegebieten ist sehr unterschiedlich, was auch saisonale und geographische Gründe hat. Im subsaharischen Afrika überwiegt Plasmodium falciparum deutlich vor allen anderen Plasmodienarten. Eine Rückkehr der Malaria nach Mitteleuropa wird von vielen Wissenschaftlern in den nächsten Jahren für unwahrscheinlich gehalten.[11]
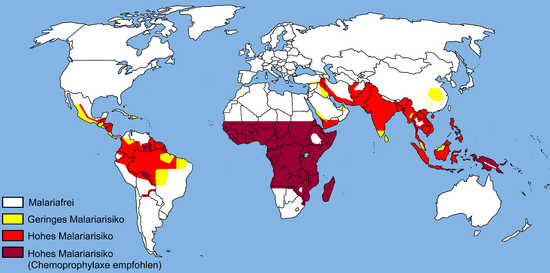
Malariarisikogebiete mit Chemoprophylaxeempfehlungen der DTG (Stand: 2005)
Genetische Mutationen und Bedeutung der Malaria in der Menschheitsgeschichte |
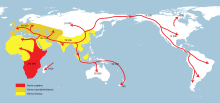
Vermutete Ausbreitung des Homo sapiens (rot) in den letzten 200.000 Jahren.
Der moderne Mensch (Homo sapiens) war während des größten Teils der Menschheitsgeschichte der Bedrohung durch Malaria-Infektionen ausgesetzt. Man schätzt, dass die ersten Vertreter des Homo sapiens vor ungefähr 200.000 Jahren in Ostafrika auftraten. Von dort breiteten sie sich allmählich über die ganze Erde aus. Die klimatisch kalten und malariafreien Regionen der Welt wurden erst in den letzten 20.000–30.000 Jahren durch moderne Menschen besiedelt.
Im Laufe der Zeit sind in der menschlichen Population Mutationen aufgetreten, die eine gewisse Resistenz gegen die schweren Verlaufsformen der Malaria bieten. Diese Mutationen betreffen die Erythrozyten (roten Blutkörperchen), in denen sich der Malaria-Parasit entwickelt. Es handelt sich in erster Linie um Mutationen in den Genen des Hämoglobins (Hämoglobinopathien), aber auch um Mutationen im Stoffwechsel der Erythrozyten:
- Bildung von Hämoglobin-Mutanten:
Sichelzellenanämie (Bildung von Hämoglobin S, im tropischen Afrika)- Hämoglobin C (in Westafrika)
- Hämoglobin E (in Südostasien)
- Hämoglobin D (in Indien)
- Verminderte Synthese des Hämoglobins:
- α-/β-Thalassämie (im Mittelmeerraum, ganz Südasien, Nordafrika)
Enzymdefekte im Erythrozytenstoffwechsel:
- Glucose-6-phosphat-Dehydrogenase (G6PDH)-Mangel
Heterozygote Anlageträger (mit nur einem mutierten Allel) können an Malaria erkranken, sind jedoch gegenüber den schweren Verlaufsformen geschützt, da sich die Malariaparasiten nicht so gut in den Erythrozyten vermehren können. Homozygote Anlageträger (beide Allele mutiert) haben unbehandelt häufig eine deutlich verkürzte Lebenserwartung (z. B. bei Sichelzellanämie), da die Funktion der Erythrozyten gestört ist.
Weltweit gesehen sind etwa 8 % der heutigen Weltbevölkerung von einer der obigen Mutationen betroffen. Die Hämoglobinopathien sind damit die bei weitem häufigsten menschlichen Erbkrankheiten. In manchen Regionen der Welt (Gebiet um die ostafrikanischen Seen, Teile Südostasiens) sind bis zu 50 % der dortigen Bevölkerung Anlageträger.
Die Tatsache, dass sich derartige Mutationen, die größtenteils erhebliche Nachteile vor allem in homozygoter Form für den jeweiligen Träger mit sich bringen, in der menschlichen Population haben halten können, ist ein eindrucksvoller Beleg dafür, welchen großen genetischen Druck die Malaria auf die Menschheitsentwicklung ausgeübt hat. In Gebieten mit seltenerem oder nur episodischem Auftreten der Malaria (Nordeuropa, Nordasien) sind die oben genannten Mutationen bei der einheimischen Bevölkerung nicht zu finden, sie sind durch den Selektionsdruck innerhalb einiger tausend Jahre eliminiert worden.
Daneben ist seit 2012 bekannt, dass es Genvariationen (Polymorphismen) in zwei Genen gibt, deren Träger seltener einen lebensgefährlichen Verlauf der Malaria zeigen. Das eine dieser Gene steuert die Zellmembranpumpe für Kalzium, die unter anderem auch auf Erythrozyten vorhanden ist, das andere spielt eine Rolle bei der Abdichtung von Gefäßwänden.
Bei Trägern der Blutgruppe 0 ist ebenso eine verringerte Wahrscheinlichkeit für einen schweren Krankheitsverlauf zu beobachten.[13]
Jährliche Opfer und Inzidenz |
Nach Angaben der Weltgesundheitsorganisation (WHO) sterben weltweit jährlich knapp eine halbe Million Menschen an Malaria.[14] 90 % der Erkrankten leben auf dem afrikanischen Kontinent. Die Zahl der Malariakranken weltweit wird nach Zahlen des Robert-Koch-Institutes auf 300–500 Millionen Fälle geschätzt.[15] Die WHO schätzte die Zahl der Malariafälle 2016 auf 216 Millionen.[16]
In Deutschland wurden bis 2013 jährlich ca. 700 Erkrankte gemeldet, von denen 3–8 starben (0,3–0,9 %). Der Großteil der Patienten ist in afrikanischen Endemiegebieten unterwegs gewesen (ca. 87 %).
| Jahr | 1980 | 1981 | 1982 | 1983 | 1984 | 1985 |
|---|---|---|---|---|---|---|
| Gemeldete Fälle in der Bundesrepublik Deutschland mit West-Berlin | 573 | 393 | 514 | 447 | 482 | 530 |
| Jahr | 1996 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gemeldete Fälle in Deutschland[17] | > 1000 | 1008 | 931 | 800 | 1049 | 860 | 820 | 709 | 632 | 569 | 542 | 554 | 526 | 633 | 563 | 551 | 638 | 1007 | 1062 |
Erreger |
Liste humanpathogener Erreger |
| ||||||||||||||||||||||||
(* bei unzureichender Malariaprophylaxe) |
Der Erreger gehört zu den Apikomplexa. Für den Menschen gefährlich sind die Erreger Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae und Plasmodium knowlesi, die verschiedene Formen der Malaria auslösen können.
Darüber hinaus kann auch Plasmodium semiovale Malaria auslösen. Bei Mehrfachinfektionen mit gleichen oder verschiedenen Plasmodien können die Fieberanfälle auch unregelmäßig sein. Das sonst regelmäßige typische Wechselfieber bleibt aus, es herrscht unregelmäßiges und gegebenenfalls dauerhaftes Fieber. Da der schizogone Zyklus von P. knowlesi 24 h beträgt, manifestiert sich diese Infektion in M. quotidiana mit täglichen Fieberanfällen.
Lebenszyklus |
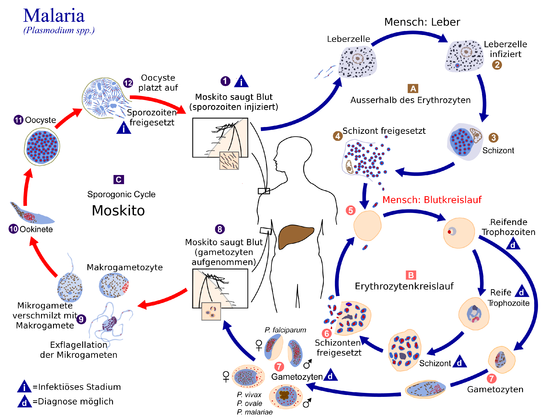
Lebenszyklus der Plasmodien
Im Laufe ihres Lebenszyklus vollziehen die Erreger der Malaria, die Plasmodien, einen Wirtswechsel. Der Mensch dient dabei als Zwischenwirt. Als Endwirt dienen Stechmücken, insbesondere der Gattung Anopheles. In ihnen findet die Vermehrung der Plasmodien statt.
Im Menschen (asexuelle Phase/Schizogonie) |
Nachdem der Mensch von einer infizierten Anopheles-Mücke gestochen wurde, sondert sie mit ihrem Speichel, welcher Gerinnungshemmer enthält, mehrere hundert Sporozoiten ab. Diese werden mit dem Blutstrom zur Leber geleitet, wo sie in die Milz und vor allem in die Zellen des Lebergewebes eindringen und darin zum Leberschizont heranreifen. Dort findet eine Vermehrung (Teilung) statt, die exoerythrozytäre Schizogonie genannt wird. Dadurch entstehen bis zu 30.000 Merozoiten. Der Schizont löst sich auf und gibt die Merozoiten schrittweise in Vesikel verschnürt in die Blutbahn ab. Bei Plasmodium vivax und Plasmodium ovale gehen nicht alle Merozoiten diesen Weg, ein kleiner Teil kann als Hypnozoit ungeteilt in der Leberzelle persistieren. In diesem Ruhezustand können sie über Monate bis Jahre unentdeckt vom Immunsystem verbleiben. Durch einen unbekannten Stimulus reifen die Hypnozoiten zu Schizonten heran, was zu charakteristischen Rückfällen der Malaria tertiana führt.[19]
Die Merozoiten gehen in den Blutkreislauf über und heften sich an Rezeptormoleküle von roten Blutkörperchen, woraufhin sie in diese eindringen können und dort innerhalb einer membranbegrenzten, parasitophoren Vakuole eingeschlossen sind. Mit dem Befall der roten Blutkörperchen beginnt die Erythrozytäre Schizogonie. Die Merozoiten reifen daraufhin zu einem Trophozoiten heran. Der Erreger erscheint in diesem Stadium als Ring um seine eigene Nahrungsvakuole mit dunkel gefärbtem, randständigem Kern. Der Throphozoit reift weiter zu einem Schizonten, der sich hauptsächlich von Glukose und Hämoglobin ernährt. Dabei entsteht Häm, das allerdings sofort zu Hämozoin kristallisiert wird, da freies Häm für den Trophozoiten toxisch wirkt. Nach Vielfachteilung gehen aus dem Schizonten je nach Plasmodium-Art 6 bis 36 Merozoiten hervor. Diese sorgen durch ihre große Menge für ein Platzen des Erythrozyten und somit für ihre Verteilung im Blutplasma. Dort können die Merozoiten weitere Erythrozyten befallen und der asexuelle Zyklus beginnt von vorn.
Die Schizogoniezyklen verlaufen nach kurzer Initialphase synchronisiert in regelmäßigen Abständen von 48 (Plasmodium vivax, ovale, falciparum, Letzteres aber unsynchronisiert) und 72 Stunden (Plasmodium malariae). Das auf die Zerstörung des Erythrozyten folgende Fieber tritt durch die Synchronisation dieses Zyklus dementsprechend alle 3 bzw. 4 Tage auf (Malaria tertiana und Malaria quartana).
Eine geringe Zahl der Merozoiten entwickeln sich weiter zu ihren Geschlechtsformen, den Gametozyten. Diese finden sich dann im Blut, wo sie nach einiger Zeit (Plasmodium vivax: 1 Tag, Plasmodium falciparum: bis zu 22 Tage) wieder absterben, sofern sie nicht von einer Anopheles-Mücke aufgenommen werden. Die männlichen Gametozyten werden Mikrogametozyten, die weiblichen Makrogametozyten genannt.
In der Mücke (sexuelle Phase/Sporogonie) |
Beim erneuten Stich einer Mücke werden die Gametozyten in die Mücke aufgenommen. Sie entwickeln sich in ihrem Darm zu Gameten. Der Mikrogamet penetriert den Makrogameten, und es entsteht eine Zygote. Diese verändert sich, nimmt eine längliche Form an und wird motil (= beweglich), diese Zelle heißt nun Ookinet. Er lagert sich zwischen den Gewebeschichten des Mückendarms an und verwandelt sich dort zur Oozyste. In ihr entstehen bis zu 1.000 neue Sporozoiten. Nach ihrer Freisetzung wandern sie in die Speicheldrüsen der Mücke und stehen nun zur Neuinfektion bereit. Der Zyklus in der Anopheles dauert abhängig von der Außentemperatur zwischen 8 und 16 Tage. Dabei ist eine Mindesttemperatur von 15 °C erforderlich. Unterhalb dieser Temperatur kommt kein Zyklus mehr zustande.
Infektionswege Mensch zu Mensch |
Ohne den Weg über eine Mücke kann Malaria von Mensch zu Mensch über Blut übertragen werden.
Dafür sind zwei Möglichkeiten bekannt:
- Über eine verletzte Plazenta bei Schwangeren während der Geburt auf ihr Kind.
- Im Zuge einer Bluttransfusion
Nach dem Tod einer 84-Jährigen am 18. März 2019 nach einer Operation mit Bluttransfusionen im Februar davor in Kärnten wurde berichtet, dass Malaria laut Staatsanwalt ihren Tod verursacht hat. Die Blutbeutel sind zu den Spendern zurückverfolgbar. Spendenwillige müssen Auslandsreisen angeben, und dürfen 6 Monate nach Rückkehr aus einem von Malaria betroffenem Gebiet nicht spenden. Gespendetes Blut wird in Österreich bisher noch nicht auf Malarieerreger untersucht.[20]
Pathogenese |

Plasmodium im Zytoplasma einer befallenen Zelle (EM-Aufnahme in Falschfarben)

Plasmodium falciparum – Ringformen
Die mit Plasmodien infizierten, reifenden und platzenden roten Blutkörperchen setzen mit den Merozoiten Toxine (z. B. Phospholipide) frei, welche wiederum zur Freisetzung von Zytokinen führen. Die Zytokine sind hauptsächlich für den Fieberanstieg und einer beobachteten Absenkung des Blutzuckerspiegels (Hypoglykämie) verantwortlich. Die mit einer Laktatazidose verbundene Hypoglykämie[21] wird nicht nur durch die Wirkung der Zytokine hervorgerufen, sondern ist auch eine Folge des Stoffwechsels der Parasiten. Ebenso kommt es bei hoher Parasitenanzahl im Blut (Hyperparasitämie) durch Auflösung (Lyse) der roten Blutkörperchen, Abbau von befallenen roten Blutkörperchen in der Milz und Dämpfung der Erythropoese im Knochenmark durch die Zytokinfreisetzung (insbesondere durch den Tumornekrosefaktor-Alpha) zu einer Anämie.
Darüber hinaus bestehen zwischen Plasmodium falciparum und den anderen Malariaerregern wichtige pathogenetische Unterschiede.
Plasmodium falciparum |
In den roten Blutkörperchen produziert der Trophozoit Proteine, wie zum Beispiel PfEMP1 (Plasmodium falciparum infected erythrocyte membrane protein 1), welches eine Bindung der infizierten Blutkörperchen an das Endothel der Blutgefäße bewirkt. Die damit verbundenen Mikrozirkulationsstörungen erklären zumindest teilweise den deutlich schwereren Verlauf der durch Plasmodium falciparum hervorgerufenen Malaria tropica.
Die Anhaftung der roten Blutkörperchen am Endothel und die mangelnde Verformbarkeit der befallenen Zellen führt zu einer Verengung der Kapillaren und somit zu einer Störung der Sauerstoff- und Nährstoffversorgung der Umgebung. Dies hat im zentralen Nervensystem besonders dramatische Auswirkungen und die häufigen zentralen Komplikationen der Malaria tropica zur Folge. Besonders kleine Kinder können in ein lebensbedrohliches Koma verfallen (cerebrale Malaria).
Übrige Plasmodien |
Die übrigen Plasmodienarten sind nicht in der Lage, am Endothel zu haften, womit auch die geringere Anzahl an Durchblutungsstörungen und somit die geringe Gefährlichkeit zu erklären ist. Plasmodium malariae unterscheidet sich von den anderen humanpathogenen Plasmodien dadurch, dass es vereinzelt auch andere höhere Primaten befällt.
Klinisches Bild, Symptomatik |
Wikipedia:WikiProjekt Ereignisse/Vergangenheit/fehlend
Aufgrund des unterschiedlichen Verlaufs der Erkrankung kann zwischen der Malaria tropica, der Malaria tertiana und der Malaria quartana unterschieden werden. Die Malaria tropica ist dabei die schwerste Verlaufsform der Malaria.
Malaria tropica |
Die Malaria tropica wird durch den Erreger Plasmodium falciparum verursacht und ist in Europa die am häufigsten eingeschleppte Malariaart.[22] Charakteristisch für die komplizierte, lebensbedrohliche Malaria tropica sind die hohe Parasitämie (mit einem Anteil von mindestens 5 % Parasiten im Blut[23]), die teils ausgeprägte Anämie und die häufig vorkommenden neurologischen Komplikationen. Es kann ein rhythmischer Fieberverlauf vorliegen. Ein Fehlen der Fieberrhythmik ist jedoch kein Ausschlusskriterium einer Malaria tropica.
Inkubationszeit |
Zwischen dem Stich der Anopheles-Mücke und dem Krankheitsausbruch liegen im Mittel zwölf (7 bis 14) Tage. Erheblich kürzere Zeitintervalle treten bei einer Infektion mit erregerhaltigem Blut auf. Längere Inkubationszeiten sind unter Einnahme einer unzureichenden Chemoprophylaxe möglich.
Fieber |
Das typische wechselnde hämorrhagische Fieber mit Schüttelfrost beim Fieberanstieg und Schweißausbrüchen bei Entfieberung, wie es bei anderen Malariaformen auftritt, wird bei der Malaria tropica in der Regel nicht beobachtet. Daher kann man eine Malaria, eine Malaria tropica insbesondere, nicht allein aufgrund der Tatsache ausschließen, dass keine typische Fieberrhythmik vorliegt. Ein hohes Fieber über 39,5 °C tritt häufig bei Kindern auf und ist als prognostisch ungünstig zu beurteilen. Häufig kommt es zu zentralen Komplikationen und Koma.
Neurologische Komplikationen |
Bewusstseinsstörungen, die bis zum Koma reichen können, stellen eine typische und auch lebensbedrohliche Komplikation der Malaria tropica dar. Dabei sind plötzliche Wechsel der Bewusstseinslage ohne Vorzeichen durchaus möglich. Es kann auch zu einer langsamen Eintrübung des Patienten kommen. Im Rahmen einer zerebralen Malaria können auch neurologische Herdsymptome wie Lähmungen und Krampfanfälle auftreten. Die normale neurologische Diagnostik führt hier kaum zu einer adäquaten Diagnose. Eine hohe Parasitenzahl im Blut dient als entscheidender Hinweis.
Bei Schwangeren und Kindern können Hypoglykämien auftreten, die allein oder mit der zentralen Problematik zum Koma führen.
Anämie |
Anämien treten häufig bei schweren Infektionen auf und sind bei einem Hämoglobinwert unter 8 g/dL eines der Zeichen einer komplizierten Malaria. Eine besondere Risikogruppe für schwere Anämien stellen Säuglinge und Kleinkinder dar. Meist handelt es sich um eine hämolytische Anämie durch Zerstörung roter Blutkörperchen. Wie oben erwähnt besitzt auch die Hemmung der Erythropoese eine gewisse Bedeutung. Die Schwere der Anämie korreliert stark mit dem Ausmaß des Parasitenbefalls.
Hämoglobinurie |
Der durch die massive Hämolyse angestiegene Hämoglobin-Spiegel im Blut führt zu einer Hämoglobinurie (daher die frühere Bezeichnung Schwarzwasserfieber), dem Ausscheiden von Hämoglobin über die Nieren. Die dadurch verursachte Erhöhung des Hämoglobinanteils im Urin färbt ihn deutlich dunkler. Die mit bloßem Auge sichtbare Hämoglobinurie zählt zu den Kriterien einer komplizierten Malaria und kann zu einem akuten Nierenversagen führen.
Veränderungen anderer Organsysteme |

Kind mit massiven Ödemen (Anasarka) aufgrund malariabedingter Niereninsuffizienz
Im Laufe der Erkrankung kann es zu einer Vergrößerung der Milz (Splenomegalie) kommen, bedingt durch die große Zahl dort abzubauender Trümmer roter Blutkörperchen. In seltenen Fällen führt das Gewebswachstum zu einer Spannung der Kapsel, so dass diese leicht einreißen kann (Milzruptur). Den Magen-Darm-Trakt betreffende Symptome wie Durchfälle sind häufig und differentialdiagnostisch von Bedeutung, da sie bei fehlendem oder schwach ausgeprägtem Fieber zur falschen Diagnose bakterielle Enteritis führen können.
In bis zu zehn Prozent der Fälle kann eine Lungenbeteiligung auftreten, die von leichten Symptomen bis zu einem Lungenödem als Kriterium einer komplizierte Malaria reichen kann.
Nicht selten kommt es durch eine Durchblutungsstörung der Niere zu einem akuten Nierenversagen. Das Nierenversagen (mit einem Kreatininwert von über 250 µmol/L) gehört zu den Kriterien einer komplizierten Malaria.[24] Nach ausgeheilter Infektion erholt sich die Niere meist.
Malaria tertiana |
Die im Vergleich zur Malaria tropicana seltenere Malaria tertiana wird durch die Erreger Plasmodium vivax und Plasmodium ovale verursacht.[25] Sie ist eine der gutartigen Verlaufsformen der Malariaerkrankung. Es treten im Vergleich zur Malaria tropica kaum Komplikationen auf. Das Hauptproblem besteht darin, die unspezifischen Vorsymptome von der lebensbedrohlichen Malaria tropica abzugrenzen. Dies gelingt meist nur in der mikroskopischen Diagnostik.
Inkubationszeit |
Die Inkubationszeit beträgt etwa zwischen 12 und 18 (zwischen 9 und 21[26]) Tagen, kann aber auch mehrere Monate dauern, wenn der Verlauf der Infektion durch die Chemoprophylaxe verlangsamt wird.
Fieber |
Nach einer unspezifischen Prodromalphase von wenigen Tagen stellt sich normalerweise die typische Dreitagesrhythmik ein, die der Malaria tertiana ihren Namen gab: Tag 1 mit Fieber, Tag 2 ohne Fieber und Tag 3 wieder mit Fieber.
Die Fieberattacken gehorchen meist folgendem Schema:
Froststadium (1 Stunde): Der Patient leidet unter Schüttelfrost und dem subjektiven Gefühl starker Kälte. In dieser Phase steigt die Temperatur steil an.
Hitzestadium (4 Stunden): Die Haut brennt häufig quälend. Es treten schwere Übelkeit, Erbrechen und Mattigkeit auf. Die Temperatur kann über 40 °C betragen, die Haut ist im Gegensatz zum nächsten Stadium meist trocken.
Schweißstadium (3 Stunden): Unter starkem Schwitzen sinkt die Temperatur bis zum Normalwert von 37 °C, Nachlassen der Mattigkeit noch vor Entfieberung.
Wie bei allen anderen Malariaformen gilt auch hier, dass das Fehlen der Fieberrhythmik keineswegs ausreicht, um die Krankheit auszuschließen.
Malaria quartana |
Die seltene, insbesondere in Afrika und Südostasien auftretende Malaria quartana (auch Quartana; veraltete deutsche Bezeichnung: „Quartanfieber“) wird durch den Erreger Plasmodium malariae verursacht. Auch hier handelt es sich um eine schwere fieberhafte, aber nur selten tödlich endende[27] Form der Malaria. Eine charakteristische Komplikation ist das nephrotische Syndrom. Besonders an dieser Form ist, dass es selbst nach einer sehr langen Zeit (> 50 Jahre) noch zu Rezidiven kommen kann. Auch ist die Inkubationszeit erheblich länger als bei den beiden anderen Formen.
Inkubationszeit |
Die Inkubationszeit beträgt zwischen 16 und 50 (meist zwischen 19 und 41) Tagen. Somit ist sie erheblich länger als bei den übrigen Krankheitsformen.
Fieber |
Die Prodromalphase ist genauso unspezifisch wie die der Malaria tertiana. Schon nach wenigen Tagen stellt sich die Vier-Tages-Rhythmik ein. Nach einem Tag mit Fieber sind zwei fieberfreie Tage zu beobachten, ehe wieder ein Tag mit Fieber folgt. Die Stadienabfolge (Frost-Hitze-Schweiß) am Fiebertag entspricht der Malaria tertiana. Auch hier gilt: fehlende Fieberrhythmik schließt die Diagnose Malaria nicht aus.
Nierenbeteiligung |
Im Verlauf der Malaria quartana kann es zu einer schweren Nierenbeteiligung kommen. Diese wird unter anderem als Malarianephrose bezeichnet. Es handelt sich hierbei um ein nephrotisches Syndrom mit folgenden Symptomen:
- niedriges Serumeiweiß Albumin (im Blutkreislauf mitverantwortlich für die Regulation des Wasserhaushalts)
- Wasseransammlung im Bindegewebe (Ödeme) und der Bauchhöhle (Aszites) durch den Albuminmangel
- erhöhtes Serumcholesterin
Epidemiologische Studien haben gezeigt, dass diese Komplikation gehäuft bei Kindern zwischen zwei und zehn Jahren im tropischen Afrika auftritt.
Rezidive |
Wie schon oben erwähnt, bilden sich im Lebenszyklus von Plasmodium vivax und Plasmodium ovale Ruheformen, die sogenannten Hypnozoiten, aus. Sie können der Anlass dafür sein, dass es nach einer Ruhephase von Monaten bis Jahren zum erneuten Ausbruch der Krankheit kommt. Diesem muss nicht unbedingt eine anamnestisch bekannte Malariaerkrankung vorausgehen. Die Rezidive sind besonders tückisch, da oft weder vom Patienten noch vom Arzt ein Zusammenhang mit der Malaria hergestellt wird. Das Besondere an Plasmodium malariae sind die Rezidive nach besonders langem krankheitsfreiem Intervall (mehrere Jahre). Rezidive nach Krankheitsfreiheit von mehr als 50 Jahren wurden beschrieben. Die Rezidive kommen aber hier nicht durch Hypnozoiten in der Leber zustande (es gibt keine Hypnozoitformen des Plasmodium malariae), sondern durch einen fortdauernden Parasitenbefall des Blutes. Dieser ist so gering, dass er mikroskopisch meist nicht nachgewiesen werden kann. Dies ist besonders in der Transfusionsmedizin in Endemiegebieten von großer klinischer Bedeutung, da es auch bei negativ getestetem Spender zu einer Malariaübertragung kommen kann, wenn Frischblut eingesetzt wird. Blutkonserven werden hingegen gekühlt gelagert, was Malaria-Erreger abtötet.[28] Rezidive können jedoch in der Regel durch medikamentöse Maßnahmen (in erster Linie unter Einsatz von Primaquin) langfristig unterbunden werden.
Diagnostik |
Zu den vor einer Therapie hilfreichen Informationen gehören Angaben zum Reiseland, zu einer bestehenden Prophylaxe sowie Vorerkrankungen.
Die Diagnose Malaria sollte mit Hilfe labordiagnostischer Methoden zur parasitologischen Speziesdifferenzierung und Bestimmung der Parasitenzahl abgesichert werden. Die in der Praxis wichtigste und kostengünstigste Methode bei Malariaverdacht ist die mikroskopische Untersuchung von normalen Blutausstrichen (Dünner Tropfen) und dem bis zu 10-fach angereicherten Dicken Tropfen unter Verwendung der Giemsa-Färbung auf Plasmodien. Eine Differenzierung der vier Plasmodien ist anhand morphologischer Kriterien möglich (siehe Maurersche Fleckung oder Schüffnersche Tüpfelung). Die ermittelte Parasiten- und Leukozytenzahl ist ein Maß der Schwere der Erkrankung. Ein negatives Ergebnis der mikroskopischen Untersuchung kann aufgrund der geringen Sensitivität dieser Methode eine Malaria jedoch nicht ausschließen.

Immunchromatographischer Malariaschnelltest (positiv für Antikörper gegen P. falciparum)
Alternativ können die Erreger der Malaria immunologisch und molekularbiologisch nachgewiesen werden. Die zur Verfügung stehenden Malaria-Schnelltests (z. B. ICT Malaria P.F.®-Test, OptiMal®-Test) beruhen auf Nachweis parasitenspezifischer Antigene. Ein negatives Ergebnis kann jedoch auch bei diesen Tests eine Malaria nicht ausschließen.[29] Das mit Abstand sensitivste Verfahren für die Malaria-Diagnostik ist die Polymerasekettenreaktion (PCR). Sie ist jedoch aufgrund des hohen Material- und Zeitaufwands für den Akutfall wenig geeignet.
Auch allgemeine Untersuchungen gehören gegebenenfalls zur Diagnostik (Labor zur Bestimmung von Blutbild, Leber- und Nierenfunktion, Blutgasanalyse, Beurteilung der Lunge mit einem Röntgenbild und der Milz durch Ultraschall sowie ein EKG).[30]
Vorbeugung und Behandlung |

Darstellung zum Kampf gegen Malaria auf einer ungarischen Sonderbriefmarke von 1962
Da kein hundertprozentiger Schutz gegen Malaria besteht (fehlende Impfmöglichkeit gegen Malaria), sollte das Risiko einer Malariaerkrankung gesenkt werden. Der wirksamste Schutz ist der Verzicht auf Reisen in Gebiete, in denen Malaria übertragen wird (Endemiegebiete). Da dies nicht immer möglich ist, ist die Vermeidung von Insektenstichen (Expositionsprophylaxe) das wichtigste Element der Malariavorbeugung. Zusätzlich sollte durch vorbeugende Einnahme (Chemoprophylaxe) oder Mitführen (Stand-by-Therapie) von Malaria-Medikamenten das Risiko verringert werden, an einer schweren Malaria zu erkranken.[31]
Unabhängig davon, ob eine Chemoprophylaxe oder eine Stand-by-Therapie gewählt wurde, muss bei jedem unklaren Fieber in den Tropen und auch lange Zeit nach der Rückkehr umgehend ein Arzt aufgesucht werden. Dieser sollte mittels eines geeigneten Bluttests den Malariaverdacht schnellstmöglich bestätigen oder ausschließen, da eine nicht rechtzeitig behandelte Malaria tropica tödlich sein kann.
Eine Spontanheilung tritt bei Malaria tropica nach maximal acht Monaten, bei Malaria tertiana nach maximal drei Jahren ein. Bei Malaria quartana gibt es keine definitive Spontanheilung.[32]
Impfung |
Zurzeit steht noch kein Impfstoff zur Verfügung. Auf diesem Gebiet wird seit Jahren geforscht, mehrere Impfstoffkandidaten wurden entwickelt. Eine Pilotierung des Impfstoffs RTS,S soll ab dem Jahr 2018[veraltet] erfolgen. Dieser vermittelt allerdings nur moderaten Schutz. Eine Reihe weiterer Impfstoffkandidaten befindet sich in klinischen Tests. Darunter sind auch Impfungen mit abgeschwächten Lebendparasiten oder solche auf mRNA-Basis (siehe Forschung).
Insektenschutz |
Der Insektenschutz (als Expositionsprophylaxe) ist der wichtigste Bestandteil der Malariavorbeugung. Dazu zählt das Tragen heller, hautbedeckender, langer Kleidung, der Aufenthalt in mückensicheren Räumen (insbesondere nachts; Klimaanlage, Fliegengitter, Moskitonetz) sowie die Behandlung von Haut und Kleidung mit moskitoabweisenden Mitteln, sogenannten Repellentien (z. B. Icaridin oder DEET). Die zusätzliche Verwendung von Insektiziden in Sprays (allen voran Pyrethroide), Verdampfern, Räucherspiralen („mosquito coils“) und ähnlichem kann zusätzlichen Schutz bieten.
Nach wie vor schützen sich jedoch viele Reisende nicht konsequent gegen Mücken. So ergab eine im April 2006 veröffentlichte Untersuchung aus Frankreich, dass weniger als 10 % der an Malaria erkrankten Patienten Maßnahmen zur Abwehr von Insekten angewendet hatten.[33]
Chemoprophylaxe und Therapie |
Insbesondere die Therapie der lebensbedrohlichen Malaria tropica sollte schnellstmöglich und im Krankenhaus erfolgen. Die Malaria tertiana und die seltene Malaria quartana sind zwar auch schwere fieberhafte Erkrankungen, enden aber nur selten tödlich.[34]
Für viele Reiseziele reicht es aus, für den tatsächlichen Krankheitsfall ein Medikament zur notfallmäßigen Eigenbehandlung (Stand-by-Therapie) mitzuführen.
Dennoch wird eine Chemoprophylaxe (Dauereinnahme von Malariamedikamenten) unter Beachtung möglicher Arzneimittelnebenwirkungen und unter Berücksichtigung der persönlichen Gesundheitssituation (Vorerkrankungen, Immunstatus, …) bei Reisen in Malariagebiete mit hohem Infektionsrisiko häufig empfohlen.
Seit dem 17. Jahrhundert wird die Chinarinde und das daraus gewonnene Chinin zur Therapie der Malaria verwendet – die Legende besagt, dass britische Kolonialisten daher regelmäßig stark chininhaltiges Tonic Water tranken und, um den damals sehr bitteren Geschmack zu verbessern, oft dieses mit Gin mischten und so den Gin Tonic erfanden. Seit Mitte des 20. Jahrhunderts haben sich die Therapiemöglichkeiten vervielfacht, und es besteht die Möglichkeit einer medikamentösen Vorbeugung (Chemoprophylaxe). Das größte Problem bei der medikamentösen Vorbeugung und Behandlung ist eine zunehmende Resistenz des Erregers, insbesondere von Plasmodium falciparum. Zudem muss stets das Malariarisiko gegen das Risiko einer schwerwiegenden Arzneimittelnebenwirkung abgewogen werden. Die Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V. empfiehlt im Regelfall (Stand 2018):[35]
- in Gebieten mit mittlerem oder geringem Malariarisiko (z. B. Mittelamerika, Südostasien und Südamerika ohne Hochrisikogebiete): keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin oder Atovaquon-Proguanil.
- in Gebieten mit hohem Malariarisiko und bekannten Resistenzen (z. B. Hochrisikogebiete in Afrika, Neuguinea, auf den Salomonen, im Landesinneren von Französisch-Guayana, Suriname und Guyana): Prophylaxe mit Atovaquon-Proguanil, Doxycyclin oder (bei begründeter medizinischer Indikation und unter Beachtung der besonderen Warnhinweise) Mefloquin.[36]
- in Gebieten mit sehr geringem Risiko (z. B. Ägypten, Paraguay): keine Prophylaxe, keine Notfalltherapie, bei Fieber Arzt aufsuchen und auf Reise hinweisen.
Des Weiteren stehen Chinin (zur Therapie, insbesondere bei der komplizierten Malaria tropica; nur unter ärztlicher Aufsicht), Dihydroartemisinin-Piperaquin (zur Behandlung; nur unter ärztlicher Aufsicht), Primaquin (Therapie der Malaria tertiana oder Malaria quartana; beugt Rezidiven vor; Verwendung zur Prophylaxe nur in Ausnahmefällen) und Proguanil (Prophylaxe; meist in Kombination mit Chloroquin; Verwendung nur noch in Ausnahmefällen) zur Verfügung.
In den frühen 1970er Jahren isolierte die chinesische Wissenschaftlerin Tu Youyou das Artemisinin, ein sekundärer Pflanzenstoff, chemisch ein Sesquiterpen, der in den Blättern und Blüten des Einjährigen Beifußes (Artemisia annua) vorkommt. Sie zeigte in den folgenden Jahrzehnten die Wirksamkeit dieses Stoffes gegen Malaria auf.[37][38] Dafür wurde sie 2011 mit dem Albert Lasker Award for Clinical Medical Research[39] und 2015 mit dem Nobelpreis für Physiologie oder Medizin[40] ausgezeichnet. Vor allem in China, Südostasien und Afrika werden daher Artemisinin-haltige Präparate (einschließlich deren Abkömmlinge Artemether, Artesunat, Arteflene und Artemotil) eingesetzt. Diese im Rahmen einer Kombinationstherapie (Artemisinin-based combination therapy) eingesetzten Präparate werden von der WHO als Mittel der ersten Wahl für die Akutbehandlung der Malaria empfohlen.[41] In Deutschland kommen hier die fixen Kombinationen aus Artemether-Lumefantrin sowie Dihydroartemisinin-Piperaquin zum Einsatz. Artesunat, das in Deutschland nicht auf dem Markt ist, aber im Bedarfsfall importiert werden kann, wird zudem als Mittel der Wahl zur Therapie der komplizierten Malaria tropica empfohlen. Bei mangelnder Verfügbarkeit von Artesunat kann gegebenenfalls auf Chinin ausgewichen werden.[42]
Die Stand-by-Therapeutika Halofantrin und Amodiaquin wurden in Europa wegen schwerer Nebenwirkungen mittlerweile vom Markt genommen, sind jedoch noch vereinzelt in Malariagebieten als Notfallmedikamente verfügbar. Halofantrin wurde mit Herzrhythmusstörungen in Verbindung gebracht, während unter der Therapie mit Amodiaquin vermehrt Leberschäden und Blutbildschäden (Agranulozytose, aplastische Anämie) auftraten.
Insbesondere in Endemiegebieten ist zum Teil noch die Kombination von Sulfadoxin-Pyrimethamin verfügbar. Diese Arzneistoffkombination wurde jedoch in Deutschland aufgrund schwerer Hautreaktionen (Stevens-Johnson-Syndrom) vom Markt genommen. Darüber hinaus gibt es vielfach Malariaerreger, die gegen diese Wirkstoffkombination resistent sind.[43]
Bei der Behandlung von Malaria müssen zunächst die asexuellen Parasiten im Blut beseitigt werden. Die WHO empfiehlt bei einer Infektion mit Plasmodium vivax Chloroquin oder eine Artemisinin-basierte Kombinationstherapie.[44] Danach sind aber in der Leber ruhende Hypnozoiten vorhanden, die Rezidive auslösen können. Zur Beseitigung der Hypnozoiten kann Tafenoquin eingesetzt werden.[45] Da Tafenoquin eine Halbwertszeit von etwa 15 Tagen besitzt, ist eine einmalige Gabe ausreichend.[46] Durch die einmalige Gabe von 300 mg Tafenoquin in Kombination mit 1500 mg Chloroquin für 3 Tage konnte bei nachgewiesener Infektion mit Plasmodium vivax in 62,4 % eine Rezidivfreiheit nach 6 Monaten erzielt werden. Nach alleiniger Gabe von Chloroquin waren lediglich 27,7 % nach 6 Monaten rezidivfrei.
In jedem Falle ist es wichtig und sinnvoll, sich rechtzeitig vor jeder Reise über die aktuelle Risiko- und Resistenzsituation zu informieren und mit einem tropenmedizinisch erfahrenen Arzt die persönliche Vorsorge zu planen.
Weltweit verbreitet sind medikamentöse Resistenzen bei Malaria tropica; vor allem in Südost-Asien und Ozeanien auch bei Malaria tertiana, bei der zudem auch eine Nachbehandlung der persistierenden Leberformen (Hypnozoiten) notwendig ist.[47]
| Therapie | M. quartana | M. tertiana | M. tropica, Knowlesi-M. | komplizierter Verlauf[49] |
|---|---|---|---|---|
| Chemoprophylaxe | Atovaquon-Proguanil, Doxycyclin, Mefloquin | |||
| Stand-by-Medikation | Atovaquon-Proguanil, Artemether-Lumefantrin | |||
| 1. Wahl | Chloroquin | Atovaquon-Proguanil, Artemether-Lumefantrin, Dihydroartemisinin-Piperaquin (letzteres nicht bei M. tertiana) | Artesunat i.v. | |
| nach Initialtherapie | Primaquin zur Abtötung der Dauerformen (Hypnozoiten) | orale Therapie entsprechend Erreger | ||
Vektorkontrolle |
Als Vektorkontrolle (Bekämpfung des Überträgers) bezeichnet man den Versuch, Neuinfektionen durch gezielte Bekämpfung der Anopheles-Mücke zu verhindern. Zu diesem Zweck werden Insektizide in den Wohnstätten der Menschen versprüht oder es wird die Verwendung von insektizidimprägnierten Bettnetzen (IIB) propagiert.
In den 1950er- und 1960er-Jahren wurde unter Federführung der WHO versucht, Malaria im Rahmen des Global Eradication of Malaria Program zu vernichten. Ein wichtiger Bestandteil der Kampagne war das Besprühen der Innenwände aller Wohnungen und Häuser mit DDT. Das Testgebiet Sardinien wurde 1950 von Malaria befreit, ohne jedoch den Vektor auszurotten.[50] Trotz der anfänglichen Erfolge wurde das Projekt Anfang der 1970er-Jahre als gescheitert eingestellt.
Der Einsatz von DDT in Wohnhäusern (Innenraumbesprühung) ist umstritten. Die Zunahme von Resistenzen gegen DDT kann seine Wirksamkeit einschränken. Das Ausbringen von DDT in Innenräumen birgt möglicherweise gesundheitliche Risiken: Es gibt Hinweise darauf, dass das DDT zu einem höheren Risiko von Fehlgeburten oder Missbildungen führen, die Samenqualität bei Männern senken oder an der Entstehung verschiedener Formen von Krebs beteiligt sein könnte.[51] Bei Langzeitstudien an Ratten, Mäusen und Hamstern konnte die kanzerogene Wirkung von technischem DDT mit Bildung von Tumoren in Leber, Lunge und dem Lymphsystem nachgewiesen werden[52] und die Internationale Agentur für Krebsforschung (IARC) der WHO stufte DDT im Jahr 2015 als „wahrscheinlich krebserregend bei Menschen“ (Gruppe 2A) ein.[53] Heute ist die Herstellung und Verwendung von DDT weltweit nur noch in wenigen Staaten zum Zwecke der Bekämpfung von Krankheitsüberträgern zugelassen. Doch selbst diese Zulassungen werden sukzessive zurückgenommen. Beispielsweise plant Indien als der letzte Großanwender von DDT zur Bekämpfung der Malaria die Verwendung bis 2020 einzustellen.[54]
Forschung |
Therapieansätze |
Die Basensequenzen in den Genomen von Plasmodium falciparum und Anopheles gambiae wurden im Herbst 2002 vollständig entschlüsselt.
Etwa zeitgleich wurden neue Malariatherapeutika, wie z. B. Atovaquon, Lumefantrin und die vom Naturstoff Artemisinin abgeleiteten Wirkstoffe Artesunat und Artemether auf den Markt gebracht. Erste erfolgversprechende Ergebnisse der Behandlung Malariakranker mit Tafenoquin und dem Antibiotikum Fosmidomycin wurden ebenso vorgestellt. Fosmidomycin blockiert den MEP-Weg (Methylerythritolphosphatweg), einen Stoffwechselweg zum Dimethylallylpyrophosphat (DMAPP). Den MEP-Weg benutzen Plasmodien, nicht aber der Mensch. Durch seine Blockade können wichtige, vom DMAPP ausgehende zelluläre Grundbausteine in Zellmembranen und Zellanker des Erregers nicht mehr synthetisiert werden.
Versuche, einen weltweit wirkenden Impfstoff gegen Malaria zu entwickeln, schlugen trotz einiger anfänglicher Erfolge jedoch bisher fehl. Das größte Problem bei der Entwicklung eines wirksamen Impfstoffes ist die hohe Variabilität der Malaria-Antigene. Eine neue Hoffnung versprechen entschärfte lebende Erreger, bei denen das Gen UIS3 eliminiert wurde. Diese Sporozoiten wurden Mäusen gespritzt, wobei keinerlei Plasmodienformen entstanden, die von der Leber (deren Befall keine Symptome hervorruft) in die roten Blutkörperchen hätten wechseln können. Das Ergebnis der Immunreaktion war eindrucksvoll: Keine einzige geimpfte Maus steckte sich nach einer Infektion mit normalen Plasmodien an, während in der Kontrollgruppe alle erkrankten.[55]
Seit 1987 ist RTS,S („Mosquirix“) in Entwicklung. Dies ist ein weiterer Impfstoff, der aus dem Hepatitis-B-Impfstoff Hepatitis-B-Virus (RTS,S) besteht, welcher zusätzlich Bestandteile (RTS,S) des circumsporozoite protein der Oberfläche des Plasmodium-falciparum-Sporozoiten sowie ein weiteres Oberflächen-Antigen (RTS,S) des Hepatitis-B-Virus trägt.[56] Dadurch wird eine Immunantwort ausgelöst, die die Plasmodien in einem frühen Stadium, noch bevor sie die Leber infizieren, bekämpft. Zusätzlich wird ein Impfschutz gegen das Hepatitis-B-Virus induziert.[57] Für einen vollständigen Immunschutz ist geplant, den Impfstoff mit weiteren Antigenen des Malaria-Erregers zu kombinieren.[58]GlaxoSmithKline führte 2010 eine Schlüsselstudie mit RTS,S durch.[59] Die Bewertung einer randomisierten Doppelblind-Studie, die mehr als 15.400 Kinder einbezog, ergab nach einem Jahr als vorläufiges Ergebnis bei einer mit RTS,S geimpften Patientengruppe eine Reduktion der Malaria-Fälle um ungefähr die Hälfte gegenüber der Kontrollgruppe; für die Untergruppe schwerer Verläufe fällt der Unterschied um ca. 5 % geringer aus.[60]
Die Ergebnisse einer klinischen Phase-III-Studie bewertet der Auftraggeber GlaxoSmithKline als positiv[61] und hat auf dieser Grundlage im Juli 2014 eine so genannte „regulatory application“ bei der europäischen Arzneimittelbehörde EMA beantragt. Damit sei eine Empfehlung der WHO Ende 2015[veraltet] möglich.[62] Nach Veröffentlichung weiterer Studienergebnisse im April 2015[63] sehen die Immunologen Vasee Moorthy und Jean-Marie Okwo-Bele (beide WHO) die Wirksamkeit und Verträglichkeit als definitiv bestätigt an.[64]
Wie eine 2012 an Mäusen durchgeführte Studie ergab, können Impfstoffe dieser Art (Anregung des Immunsystems, um die Plasmodien am Eindringen in die roten Blutkörperchen zu hindern) jedoch zur Herausbildung besonders aggressiver Erregerstämme mit deutlich schwererem Krankheitsverlauf führen.[65]
US-Forschern ist es 2013 gelungen, Plasmodium falciparum so zu kultivieren, dass daraus ein Impfstoff hergestellt werden kann.[66][67]
Ein alternativer Therapieansatz könnte im Sinne einer passiven Immunisierung einen Antikörper gegen Plasmodien verwenden.
Ein weiterer Ansatz aktueller Forschung ist, die Vermehrung der Plasmodien zu verhindern. Untersuchungen an Mäusen zeigten, dass es prinzipiell möglich ist, über einen Impfstoff die Verschmelzung weiblicher und männlicher Keimzellen des Plasmodiums zu blockieren, und somit die Weitergabe des Erregers einzudämmen.[68][69]
Eine weitere Möglichkeit der Bekämpfung der Malaria ist das Unterbrechen der Infektionskette durch Bekämpfen der Anopheles-Mücke. Ein entsprechender Versuch zur Ausrottung der Malaria in den 1960er Jahren mit Hilfe von DDT (Dichlordiphenyltrichlorethan) war nur örtlich und zeitlich begrenzt erfolgreich; in der Folgezeit wurden umweltschädigende Wirkungen offenbar. Ein neuer Ansatz ist der Einsatz des Bakteriums Bacillus thuringiensis israelensis (bti), das im Labor einfach vermehrt werden kann (siehe Bacillus thuringiensis). Bti ist gegenüber Stechmücken erprobt und hochwirksam, schont aber bei richtiger Anwendung „Nicht-Ziel-Organismen“ weitgehend. Zur Anwendung werden Bti-Sporen in von Anopheles-Larven bewohnte Gewässer ausgebracht. Die Larven nehmen die Bakterien mit der Nahrung auf. In ihrem Darm setzen Verdauungsenzyme ein Delta-Endotoxin aus der Sporenwand frei; dieses Eiweiß tötet Zellen der Darmwand, indem es kationen-durchlässige Poren in deren Membran erzeugt. Die Insekten stellen daraufhin ihre Nahrungsaufnahme ein und gehen noch im Larvenstadium zugrunde. Bti wird in flüssiger, Tabletten-, Pulver- und Granulatform kommerziell angeboten. Für den großflächigen Einsatz im Freiland hat sich die Verwendung von Granulat bewährt; bei starker Durchseuchung von Gewässern wird dieses mit Hubschraubern ausgebracht.
Außerdem forscht die gemeinsame Abteilung der IAEO und FAO an einer neuartigen Methode zur Bekämpfung der Anopheles-Mücke durch massenweise Aussetzung steriler Mückenmännchen (Sterile-Insekten-Technik).
In Anbetracht der zunehmenden Resistenz gegen die in den letzten Jahrzehnten entwickelten Wirkstoffe rückt seit 2002 die synergistische Wirkung der länger bekannten Wirkstoffe Methylenblau und Chloroquin ins Blickfeld der Forschung.[70][71]
In Zusammenarbeit mit der WHO erarbeiten gegenwärtig das Kenya Medical Research Institute und die britische Universität Oxford im Internet verfügbare Weltkarten, auf denen das gesamte Wissen über die Verbreitung der Malaria zusammengetragen wird (z. B. Infektionsrate Plasmodium falciparum, Plasmodium vivax). Dieses Malaria Atlas Projekt genannte Unterfangen wird vom englischen Wellcome Trust finanziert und ständig erweitert.[72]
Ein neuer Therapieansatz ist die Bekämpfung von Plasmodium im Mückendarm durch genetisch veränderte Mückendarmflora. Das mit Anopheles in Symbiose lebende Bakterium Pantoea agglomerans wird dabei so verändert, dass es gegen den Parasit wirksame Peptide ausscheidet. Mit dem Ansatz kann die Prävalenz infizierter Mücken stark gesenkt werden.[73]
In einer Studie wurden im Blut von Kleinkindern aus Tansania Antikörper gegen ein bisher unbekanntes Antigen PfSEA-1 entdeckt, die sie offenbar vor einer schweren Malariaform schützt.[74] Das neu entdeckte Antigen PfSEA-1 hilft dem Malaria-Parasiten, sich im Blut zu vermehren, in des es ihm ermöglicht, die roten Blutkörperchen zu verlassen und andere Blutzellen zu befallen. Die ebenfalls neu entdeckten Antikörper gegen das Antigen PfSEA-1 können genau diesen Effekt verhindern. Untersuchungen haben bei etwa sechs Prozent von mehr als 450 Kindern diesen natürlichen Schutzfaktor nachgewiesen und keines von diesen Betroffenen erkrankte an einer schweren Malaria. Diese Erkenntnisse wurden anschließend an etwa 140 jungen Erwachsenen aus dem Nachbarland Kenia überprüft. Dabei stellte sich heraus, dass bei Menschen mit dem Antikörper gegen PfSEA-1 die Parasitendichte im Blut etwa um die Hälfte verringert war. Im Schnitt hatten 56 von 100 Erwachsenen dieser Altersgruppe solche Antikörper. Die Forscher vermuten, dass der Kontakt zum Erreger die Produktion des Schutzproteins anregt, was auch erklären könnte, warum Malaria in diesen Ländern bei Erwachsenen tendenziell weniger schwer verläuft als bei Kindern.[75]
Anfang 2014 vermeldeten die University of Edinburgh und das Biotechunternehmen CILIAN AG, einen Impfstoff entdeckt zu haben, der eine Vielzahl von Genvariationen des Malaria-Erregers abdecke und bei Tieren eine starke Immunreaktion hervorgerufen habe. Die Produktion dieses Wirkstoffes erfolgt dabei durch biotechnische Bearbeitung von Einzellern.[76][77]
Das synthetische Spirotetrahydro-β-carbolin-Derivat mit dem vorläufigen Namen KAE609 (vorher NITD609) wurde von Novartis entwickelt und zeigte in einer Phase-II-Studie an drei thailändischen Zentren eine gute dosisabhängige Antimalariaaktivität gegen asexuelle und sexuelle Stadien von Plasmodium falciparum und Plasmodium vivax. Dabei zeigte sich eine Parasiten-Clearance im Median nach zwölf Stunden. Dieses Spiroindolon-Analog hemmt die in der Parasiten-Plasmamembran lokalisierte Na+-ATPase, die für die Natrium- und osmotische Zell-Homöostase wichtig ist.[78]
Verteiltes Rechnen |
Es existieren derzeit (Stand August 2013) mehrere nicht-kommerzielle Projekte des verteilten Rechnens für die Suche nach neuen Medikamenten resp. effektiven Gegenmaßnahmen. Dabei können Privatpersonen die überschüssige Rechenzeit ihres Computers zur Verfügung stellen.
Das World Community Grid-Projekt GO Fight Against Malaria wurde Mitte 2013 erfolgreich abgeschlossen; die Datenauswertung läuft per Juli 2014 noch, erste Ergebnisse werden von den Projektinitiatoren als „vielversprechend“ eingeschätzt[79] und haben auch zu einer wissenschaftlichen Publikation geführt.[80] Aktiv sind aktuell die Projekte FightMalaria@Home sowie Malaria Control.
Körpergeruch bei Erkrankten |
In mehreren Studien wurde nachgewiesen, dass eine Infektion mit Plasmodium den Körpergeruch der Infizierten derart verändert, dass die Plasmodium übertragenden Insekten verstärkt von den Infizierten angelockt werden. Dies kann zur raschen und effektiven Verbreitung der Erreger beitragen.[81][82][83]
Armutsbedingte Krankheit |
Die Malaria wird auch als armutsbedingte Krankheit bezeichnet. Hinter dieser Bezeichnung steht zum einen das Kalkül, dass von der Krankheit hauptsächlich arme Menschen betroffen sind, die über wenig Kaufkraft verfügen und folglich keinen attraktiven Markt bilden. Für Pharmaunternehmen ist es daher ökonomisch sinnvoller, Mittel gegen medizinisch weniger „dringende“ Krankheiten zu erforschen, deren Betroffene kaufkräftiger sind.
Norbert Blüm schrieb 2003 dazu:
„Die Pharmaindustrie gibt weltweit doppelt so viel Forschungsmittel im Kampf gegen Haarausfall und Erektionsschwächen aus wie gegen Malaria, Gelbfieber und Bilharziose. Das ist marktwirtschaftlich konsequent, denn die Kunden mit Erektionsschwächen und Haarausfall haben in der Regel mehr Kaufkraft als die Malaria- und Gelbfieberkranken.“[84]
Die Europäische Union will als Reaktion auf diesen Mechanismus die Entwicklung von Mitteln gegen armutsbedingte Krankheiten mit 600 Millionen Euro fördern.[85]
Andererseits ist es fraglich, ob gerade für Regionen, in denen die Malaria wie die Armut verbreitet sind, die Bekämpfung der Malaria durch Entwicklung eines Impfstoffes im Vordergrund stehen sollte. Der Parasitologe Paul Prociv weist darauf hin, dass Erwachsene in Malariagebieten durch ständige Reinfektion praktisch immun gegen die Krankheit sind. Vorrang hätte die Hebung der allgemeinen Gesundheitsfürsorge und Lebensumstände. Von einem Malariaimpfstoff würden hauptsächlich westliche Besucher der Tropen profitieren, die die Nebenwirkungen der herkömmlichen Malariavorsorge scheuen.[86]
Als armutsbedingte Erkrankung kann Malaria auch gelten, da in vielen Ländern der so genannten Dritten Welt die Wohnverhältnisse der meisten Menschen nicht den Standards zur Infektionsvermeidung (geschlossene Wohnräume, Moskitonetze, Klimaanlage, Insektensprays usw.) entsprechen, keine Chemoprophylaxe zur Verfügung steht und Medikamente teuer und schwer zu beschaffen sind[11] (siehe auch Abschnitt Vorbeugung und Behandlung).
Aufgrund der mangelnden finanziellen Unterstützung gab Bill Gates Ende Oktober 2005 bekannt, dass er zur Förderung der Malariaforschung eine Summe von 258,3 Millionen Dollar zur Verfügung stellen werde. Seiner Meinung nach stelle „es für die Welt eine Schande dar, dass sich in den letzten 20 Jahren jene durch Malaria hervorgerufenen Todesfälle verdoppelten, zumal gegen jene Krankheit sehr stark vorgegangen werden könnte.“[87]
Volkswirtschaftliche Auswirkung |
Nach Jeffrey Sachs sind tropische Krankheiten, insbesondere aber Malaria, eine Hauptursache für die wirtschaftliche Misere der ärmsten Länder der Erde: Wo diese Krankheit auftritt, also vor allem in den Tropen und Subtropen, herrscht auch Armut. So hatten Mitte der 1990er-Jahre von Malaria heimgesuchte Länder ein durchschnittliches Volkseinkommen von rund 1500 US-Dollar pro Kopf, während nicht betroffene Länder mit durchschnittlich 8200 US-Dollar über mehr als das Fünffache verfügten. Volkswirtschaften mit Malaria sind zwischen 1965 und 1990 durchschnittlich nur um 0,4 Prozent im Jahr gewachsen, die anderen dagegen um 2,3 Prozent.[88]
Der durch die Krankheit verursachte volkswirtschaftliche Schaden für Afrika allein wird umgerechnet auf rund 9,54 Milliarden Euro pro Jahr geschätzt.
Nach Studien liegt die durch Malaria verursachte Lähmung der Volkswirtschaften der betroffenen Länder nicht nur an den direkten Kosten für Medikamente und medizinische Behandlung. Malaria hat eine negative Auswirkung auf die Arbeitsproduktivität und somit auf das Bruttoinlandsprodukt des Landes, womit nötige Investitionen, wie beispielsweise in Bildung, ausbleiben. Zudem meiden ausländische Investoren solche Länder ebenso wie Touristen und Handelsunternehmen.[89]
Mittlerweile hat AIDS die ungünstige Situation für diese Länder noch dramatisch verschlimmert.
Geschichte |

Aus einem Brief Dürers an seinen Arzt. Dürer zeigt auf seine schmerzende Milz. Er hatte sich möglicherweise bei einem Holland-Aufenthalt eine Malaria zugezogen.
Die frühesten Berichte von Malariaepidemien stammen von den Alten Ägyptern (u. a. aus dem Papyrus Ebers). Die ältesten DNA-Funde wurden neuerdings dann auch von Münchener Pathologen um Andreas Nerlich in zwei ägyptischen Mumien aus Theben gefunden, die ca. 3500 Jahre alt sind.[90] Aber auch in rund 3000 Jahre alten indischen Schriften taucht das Wechselfieber als „Königin der Krankheiten“ auf. Die Chinesen hatten vor über 2000 Jahren sogar schon ein Gegenmittel. Sie nutzten den Einjährigen Beifuß (青蒿, qīnghāo). In der Neuzeit konnten Forscher tatsächlich einen wirksamen Stoff aus dieser Pflanze isolieren: das Artemisinin (chinesisch Qinghaosu).
In der Antike verbreitete sich die Malaria rund um das Mittelmeer. Hippokrates erkannte, dass Menschen aus Sumpfgebieten besonders häufig betroffen waren, jedoch vermutete er beziehungsweise vermuteten die hippokratischen Ärzte, dass das Trinken von abgestandenem Sumpfwasser die Körpersäfte (siehe Humoralpathologie) in ein Ungleichgewicht bringt. Von unsichtbaren Krankheitserregern wusste man damals noch nichts. Der Begründer der Humoralpathologie Polybos nahm als Ursache aller Fiebertypen einen Überschuss an Gelber Galle an.[91]
In Rom baute Galenos die antike Fieberlehre dann weiter aus[92] und ordnete dem Übermaß an Schwarzer Galle die „Quartana“ und an Gelber Galle die „Tertiana“ zu. Eine Fieberform mit täglichen Fieberschüben (febris quotidiana) wurde seit Galenos als durch übermäßig vorhandendes bzw. verdorbenes Phlegma verursacht angesehen.[93][94]
Auch das Römische Reich wurde regelmäßig von schweren Malariaepidemien heimgesucht. Einige Historiker gehen sogar davon aus, dass sie einen der entscheidenden Faktoren für den Untergang des Römischen Reiches darstellen. Bei Rom wurde ein Kindermassengrab mit über 50 Leichen entdeckt, das auf das Jahr 50 datiert wurde. Aus den Knochenresten dieser Kinderskelette konnte die DNA von Plasmodium falciparum isoliert werden.
Um 1560 versuchte der italienische Anatom und in Palermo als Protomedicus tätige Giovanni Filippo Ingrassias (um 1510 –1580) durch Trockenlegung von Sümpfen die Malaria zu bekämpfen.[95]
Im Mittelalter bis zur Mitte des 20. Jahrhunderts war die Malaria nicht nur in Süd-, sondern auch in Mitteleuropa verbreitet. Vor allem große Gebiete Italiens waren bis ins 20. Jahrhundert von Malaria geplagt. Im deutschen Sprachraum war die Malaria zuerst vor allem am Oberrhein und im Bodensee-Gebiet anzutreffen. In Norddeutschland war das Wechselfieber auch als Marschenfieber bekannt. Berühmte europäische Malariapatienten waren Albrecht Dürer (obwohl der Krankheitsverlauf Zweifel zulässt, ob es sich wirklich um eine Malaria-Erkrankung handelte), Oliver Cromwell, Friedrich Schiller und Johann Gottfried Tulla. Während die Malaria Mitte des 19. Jahrhunderts in Deutschland noch weit verbreitet war, ging – bezeugt auch durch Angaben bei Robert Koch – die Zahl der daran Erkrankten gegen Ende des Jahrhunderts stark zurück.[96] Erst durch die systematische Trockenlegung von Sumpfgebieten und durch den systematischen Einsatz von Insektiziden konnte die Malaria in den 1960er Jahren in Europa ausgerottet werden.

Chinarinde (Chinchona sp.)
Aus Nord- und Südamerika sind die ersten Malariafälle erst im 16. Jahrhundert dokumentiert. Man geht heute davon aus, dass sie durch die Europäer bzw. durch den von ihnen organisierten Sklavenhandel dort eingeschleppt worden ist. Der Erreger verbreitete sich dort sehr schnell: Zu Beginn des 20. Jahrhunderts starben beispielsweise im Süden der USA ein Prozent der Bevölkerung jährlich an Malaria, in den Sumpfgebieten des Mississippi lag die Mortalitätsrate sogar bei drei Prozent.[97] Das Heilmittel, das heute noch Verwendung findet, hat seinen Ursprung jedoch auch in Südamerika. Peruanische Arbeiter bekämpften Fieber erfolgreich mit der Rinde eines Baumes aus der Familie der Rötegewächse, zu denen auch die Kaffeepflanze gehört. Mitglieder des Jesuitenordens beobachteten diese Wirkung und brachten das Mittel in Pulverform erstmals 1640 nach Europa, wo es auch „Jesuitenpulver“ genannt wurde. Der Baum wurde später als „Chinarinde“ (Cinchonia) bekannt, das Medikament als „Chinin“. Chinin hat einen äußerst bitteren Geschmack. Es wird als Aromastoff für Tonic Water und Bitter Lemon verwendet. Bis heute hält sich die Legende, regelmäßiges Trinken von Gin Tonic schütze vor Malaria. Jedoch ist heutzutage die Chininkonzentration in einem Gin-Tonic-Drink viel zu gering.
Der Malariaerreger wurde am 6. November 1880 vom Franzosen Alphonse Laveran entdeckt, der in Constantine (Algerien) am Militärkrankenhaus arbeitete. Er erhielt dafür 1907 den Nobelpreis für Medizin.

Ronald Ross
Ronald Ross, Chirurg und General aus England, fand 1897 den Zusammenhang zwischen dem Malariaerreger und dem Stich der Anophelesmücke heraus und erhielt dafür 1902 den Nobelpreis für Medizin. Den Zusammenhang zwischen Mücken und Malaria hatten im übrigen schon die alten Ägypter 3000 v. Chr. erkannt. Sie wurde als Fluch der Götter bzw. des Nils angesehen.
Julius Wagner-Jauregg infizierte 1917 einige seiner Patienten gezielt mit Malaria, um mit den auftretenden Fieberschüben die progressive Paralyse zu behandeln. Diese sogenannte Malariatherapie erwies sich als erfolgreich und wurde bis zum Aufkommen von Antibiotika praktiziert, 1927 erhielt Wagner-Jauregg dafür den Medizin-Nobelpreis. Wegen der damit verbundenen Risiken gilt der Einsatz von Malaria als Therapeutikum heute jedoch als nicht mehr vertretbar.
1934 gelang Hans Andersag die Entdeckung des Chloroquins (Resochin genannt), eines sehr effektiven Wirkstoffs gegen Malaria, im Labor von Bayer in Wuppertal-Elberfeld (seinerzeit Teil der I. G. Farbenindustrie AG).
In Berlin kam es 1946 zu einer der letzten Malaria-Epidemien; sie ging von befallenen Soldaten aus Afrika und Südosteuropa aus.
In den 1950er-Jahren begann die WHO das Global Eradication of Malaria Program. Neuansteckungen durch Mückenstiche sollten durch Besprühen der Innenwände der Häuser mit DDT-Lösung verhindert werden. Parallel dazu sollten die bereits Erkrankten mit Chloroquin behandelt werden, um auch die eigentlichen Erreger, die Plasmodien, zu bekämpfen.
Die Kampagne war nur teilweise erfolgreich. In den Niederlanden, Italien, Polen, Ungarn, Portugal, Spanien, Bulgarien, Rumänien und Jugoslawien wurde Malaria bis Ende der 1960er Jahre dauerhaft ausgerottet. Auch in vielen Ländern Asiens sowie Süd- und Mittelamerikas konnte die Zahl der Neuansteckungen mit Malaria drastisch gesenkt werden. Hier wurden häufig nach ersten Erfolgen Geld und medizinisches Personal aus den Anti-Malaria-Kampagnen abgezogen und anderweitig eingesetzt. Dadurch blieben neue Malariafälle unentdeckt oder konnten nicht ausreichend behandelt werden. Im Lauf der Jahre traten DDT-Resistenzen bei verschiedenen Arten der Anophelesmücke auf. Zudem waren auch die Plasmodien teilweise gegen Chloroquin resistent geworden.
Die WHO stellte ihr Programm zur Ausrottung der Malaria 1972 offiziell als gescheitert ein.
Die Chinesin Tu Youyou isolierte 1971 den zur Behandlung der Malaria eingesetzten sekundären Pflanzenstoff Artemisinin aus dem Einjährigen Beifuß (Artemisia annua, chinesisch: Qinghao) und wurde dafür 2015 mit dem Medizinnobelpreis ausgezeichnet.[98]
2007 beschloss die WHO den Weltmalariatag (World Malaria Day), ein Aktionstag, der jährlich zum 25. April stattfindet.
Siehe auch |
Erreger/Überträger: Parasiten des Menschen, Sporozoen, Protozoeninfektion
Bekämpfung: Moskitonetz, Zimtöl, DDT, Heptachlor
Pflanzliche Heilmittel: Sauerdorngewächse, Artemisia (Pflanze) bzw. Einjähriger Beifuß (Artemisinin), auch: Blauer Eisenhut, Gelber Enzian, Cannabis, Schwarzdorn-Akazie, Gewöhnlicher Buchsbaum, Afrikanischer Affenbrotbaum
Medikamente: Primaquin, Sulfonamid, Tetracycline
Immunität: Sichelzellenanämie (Erythrozyt), Favismus (G6PD-Mangel), Immunität (Medizin)
- European Mosquito Control Association
Literatur |
Leitlinien |
Leitlinie "Malaria, Diagnostik und Therapie"; DTG; Hrsg.: AWMF Stand 16. August 2016, PDF 0,32 MB
Deutschsprachige Bücher |
Jürgen Knobloch: Malaria – Grundlagen und klinische Praxis. Uni-Med, Bremen 2002, ISBN 3-89599-623-8.- Waldemar Malinowski: Impfungen für Auslandsreisende und Malariaprophylaxe. Vademecum für niedergelassene Ärzte. Facultas, Wien 2001, ISBN 3-85076-538-5.
Hochschulschriften |
- Margot Kathrin Dalitz: Autochthone Malaria im mitteldeutschen Raum Halle (Saale) 2005, (Online Dissertation Martin-Luther-Universität, Halle-Wittenberg 2005, 87 Seiten, Gutachter: G. Ockert, A. Oehme, St. Schubert (Leipzig) Volltext online PDF, kostenfrei, 87 Seiten, 1,87 MB).
- Desirée Bianca Wollgramm: Die Verbreitung und Bekämpfung der autochthonen Malaria in Deutschland – 1850 bis 1900, Düsseldorf 2016, DNB 1121174647 (Online-Dissertation Universität Düsseldorf 2016, 134 Seiten, Akademischer Betreuer: Alfons Labisch, Gutachter: Carsten Münk Volltext online PDF, kostenfrei, 134 Seiten, 229 Seiten).
Englischsprachige Bücher |
- Peter Perlmann, Marita Troye-Blomberg: Malaria Immunology. Karger, Basel 2002, ISBN 3-8055-7376-6.
- David Sullivan, Sanjeev Krishna (Hrsg.): Malaria. Drugs, disease and post-genomic biology. Springer, Berlin 2005, ISBN 3-540-25363-7.
- David A. Warrell, Herbert M. Gilles: Essential Malariology. Arnold, London 2002, ISBN 0-340-74064-7.
Zeitschriften-Beiträge und Buch-Artikel |
- Joel G. Breman, Martin S. Alilio, Anne Mills: The intolerable burden of Malaria II. In: The American journal of tropical medicine and hygiene. Band 71, Heft 2, Supplement. American Society of Tropical Medicine and Hygiene, Northbrook 2004, ISSN 0002-9637.
- B. M. Greenwood, K. Bojang, C. J. Whitty, G. A. Targett: Malaria. In: The Lancet. Band 365, Nummer 9469, 2005, ISSN 1474-547X, doi:10.1016/S0140-6736(05)66420-3, PMID 15850634, S. 1487–1498 (Review).
- Giacomo Maria Paganotti, Claudia Palladino, Mario Coluzzi: Der Ursprung der Malaria. In: Spektrum der Wissenschaft. 2004, Nr. 3, Heidelberg 2004, ISSN 0170-2971, S. 82–89.
- August Stich, Katja Fischer, Michael Lanzer: Eine Seuche auf dem Vormarsch – Die Überlebensstrategie des Malariaerregers. In: Biologie in unserer Zeit. 2000, Band 30, Heft 4, ISSN 0045-205X, S. 194–201.
- W. A. Maier: Umweltveränderungen und deren Einflüsse auf krankheitsübertragende Arthropoden in Mitteleuropa am Beispiel der Stechmücken. In: Denisia. Band 6 ISSN 1608-8700; zugleich: Kataloge des Oberösterreichischen Landesmuseums. Neue Folge, Nr. 184, 2002, S. 535–547, Volltext (PDF).
- Jochen Wiesner, Regina Ortmann, Hassan Jomaa, Martin Schlitzer: Neue Antimalaria-Wirkstoffe. In: Angewandte Chemie. 2003, Band 115, Heft 43, ISSN 0044-8249, S. 5432–5451.
- I. Stock: Therapie der Malaria. In: Medizinische Monatsschrift für Pharmazeuten. 2004, Band 27. Heft 8, ISSN 0342-9601, S. 260–272.
- H. Idel: Malaria. Prophylaxe und reisemedizinische Bedeutung. In: Bundesgesundheitsblatt. Nr. 5, Springer, Berlin 1999, ISSN 1436-9990, S. 402–407.
- Helge Kampen: Vektor-übertragene Infektionskrankheiten auf dem Vormarsch? Wie Umweltveränderungen Krankheitsüberträgern und -erregern den Weg bereiten. In: Naturwissenschaftliche Rundschau. 2005, Band 58, Heft 4, ISSN 0028-1050, S. 181–189.
Malaria Journal. Fachjournal im Open Access (englisch)- Winfried Schröder, Marcel Holy, Roland Pesch, Gunther Schmidt: Klimawandel und zukünftig mögliche temperaturgesteuerte Malariatransmission in Deutschland. In: Umweltwissenschaften und Schadstoffforschung. Band 22, Heft 3, 2010, ISSN 0934-3504, S. 177–187.
- (Louis) Pasteur Vallery-Radot: La lutte contre le paludisme. In: Revue des deux Mondes. Band 17, Nr. 8, 1933, S. 899–921.
- Patrice Bouree: La lutte contre le paludisme en France au cours de siècles. In: Histoire des sciences médicales. 1982, Band 17, Numéro spécial 1, S. 136–141 (ISSN 0440-8888).
- Manfred Vasold: Wechselfieber. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1468.
- Ulrike Roll: Malaria. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. Berlin / New York 2005, S. 886 f.
- Martin Kappas: Klimatologie: Klimaforschung im 21. Jahrhundert – Herausforderung für Natur- und Sozialwissenschaften. Spektrum, Heidelberg 2009, ISBN 978-3-8274-1827-2; 7.2.1. Auswirkungen von Temperaturveränderungen auf die Malariaübertragung; 7.2.2. Auswirkungen von Niederschlagsveränderungen auf die Malariaübertragung eingeschränkte Vorschau in der Google-Buchsuche.
- Fritz H. Kayser u. a.: Taschenlehrbuch medizinische Mikrobiologie. 11. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-444811-4.
- Charles C. Mann: Kolumbus’ Erbe. Wie Menschen, Tiere, Pflanzen die Ozeane überquerten und die Welt von heute schufen. 2. Auflage. Rowohlt, Hamburg 2013, ISBN 978-3-498-04524-1. (Auswirkungen der Malaria-Einschleppung durch Europäer auf frühe amerikanische Kolonien)
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 214–217 (Malaria).
Weblinks |
Malaria – Informationen des Robert Koch-Instituts
Empfehlungen zur Malariaprophylaxe der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V. (DTG)
Weltkarte für Malaria-Prophlaxe-Empfehlungen für das Jahr 2017 (Memento vom 20. April 2018 im Internet Archive)- WHO World Malaria Report 2017
Guidelines for the treatment of malaria (WHO-Empfehlungen für die Behandlung der Malaria), WHO (PDF 2,6 MB), 3. Aufl. April 2015 (englisch)
Erbgutsequenz von Plasmodium falciparum ist entschlüsselt. (Nature)
Malaria – eine bekannte Krankheit? (OEW)- Matthias Giger: „Rückblick in die Geschichte der Malaria und historische Behandlungsmethoden.“ 1999.
Geschichte der Malaria in den Nordseemarschen (englisch)- D. Sägesser, B. Thoet: Lernprogramm für Studierende der Medizin. Dissertation Universität Bern, Abteilung für Unterrichtsmedien (AUM). Bern 1999, 2005.
- Interaktive Abfrage von Fallzahlen und Inzidenzen meldepflichtiger Infektionskrankheiten in Deutschland.
MARA/ARMA Project Malaria-Risikokarten für Afrika
Malaria-Atlas-Projekt finanziert durch den Wellcome Trust (englisch)
Parasit ohne Gnade. Dokumentation von Heiner Schirmer auf dctp.tv.
TED-talk about "Cheese, dogs and a pill to kill mosquitoes and end malaria" at TEDxMaastricht,·Apr 2012
thinglink.com Multimedia-Collage – 10 Jahre Kampf
Einzelnachweise |
↑ abcd Bernhard Nocht, Martin Mayer: Die Malaria. Eine Einführung in ihre Klinik, Parasitologie und Bekämpfung. Zweite erweiterte Auflage. Springer-Verlag, Berlin/Heidelberg 1936, ISBN 978-3-642-89400-8, S. 2 (eingeschränkte Vorschau in der Google-Buchsuche – Softcover Reprint of the Hardcover 2nd Edition 1936).
↑ Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 470–472.
↑ Christopher JL Murray, Lisa C. Rosenfeld, Stephen S. Lim, Kathryn G. Andrews, Kyle J. Foreman: Global malaria mortality between 1980 and 2010: a systematic analysis. In: The Lancet. Band 379, Nr. 9814, 4. Februar 2012, S. 413–431, doi:10.1016/s0140-6736(12)60034-8, PMID 22305225 (thelancet.com [abgerufen am 27. Juni 2017]).
↑ A. Pain, U. Böhme u. a.: The genome of the simian and human malaria parasite Plasmodium knowlesi. In: Nature. Band 455, Nummer 7214, Oktober 2008, S. 799–803, ISSN 1476-4687. doi:10.1038/nature07306. PMID 18843368. PMC 2656934 (freier Volltext).
↑ Deutsche Gesellschaft für Tropenmedizin und internationale Gesundheit e.V.: Leitlinie: Diagnostik und Therapie der Malaria. Juli 2016.
↑ Merkblaetter: Ratgeber Malaria. Robert-Koch-Institut
↑ D. Crotti: La Malaria, ossia la mal'aria: brevi note di una "storia sociale e populare" In: Le Infezioni in Medicina, Nr. 4, 2005, S. 265–270. (Memento des Originals vom 25. Februar 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.infezmed.it
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.infezmed.it
↑ Max Höfler: Deutsches Krankheitsnamen-Buch. München 1899, S. 390.
↑ Wolf-Dieter Müller-Jahncke: Chinarinde. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 243.
↑ Planet Wissen: Geschichte der Malaria.
↑ abc Paul Reiter: Global warming and vector bourne diseases. 28. Juli 1998.
↑ Karin Rives: Study: Climate Change Contributes to Malaria Spread. But changing farming practices, migration also cause outbreaks in new areas. (Memento des Originals vom 9. Mai 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.america.gov 14. April 2010.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.america.gov 14. April 2010.
↑ Malaria: Zwei neue Resistenzgene. In: Deutsches Ärzteblatt. 16. August 2012, abgerufen am 3. Februar 2014.
↑ Key points: World malaria report 2017. Abgerufen am 25. Januar 2018 (britisches Englisch).
↑ Robert-Koch-Institut: Malaria: RKI-Ratgeber Infektionskrankheiten – Merkblätter für Ärzte.
↑ Key points: World malaria report 2017. Abgerufen am 25. Januar 2018 (britisches Englisch).
↑ (für Fallzahlen ab 2001): Robert-Koch-Institut: SurvStat (Memento des Originals vom 27. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www3.rki.de
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www3.rki.de
↑ Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 470.
↑ S. E. Lindner, J. L. Miller, S. H. Kappe: Malaria parasite pre-erythrocytic infection: preparation meets opportunity. In: Cellular microbiology. Band 14, Nummer 3, März 2012, S. 316–324, ISSN 1462-5822. doi:10.1111/j.1462-5822.2011.01734.x. PMID 22151703. PMC 3907120 (freier Volltext). (Review).
↑ Frau nach Operation an Malaria gestorben orf.at, 20. März 2019, abgerufen 20. März 2019.
↑ Zu den Kriterien einer komplizierten Malaria zählen eine Azidose mit einem pH-Wert unter 7,25 und eine Hypoglykämie mit einem Blutzuckerspiegel von unter 40 mg/dl. Vgl. Marianne Abele-Horn (2009), S. 214.
↑ Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 470–472: Malaria (Wechselfieber).
↑ Marianne Abele-Horn (2009), S. 214.
↑ Marianne Abele-Horn (2009), S. 214.
↑ Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 470.
↑ Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 470.
↑ Marianne Abele-Horn (2009), S. 214.
↑ Institut für Infektionskrankheiten/ Medizinische Fakultät der Universität Bern: Malaria. Ein Lernprogramm für Studierende der Medizin; Abschnitt: Transfusions-Malaria. Auf: e-learning.studmed.unibe.ch Revision im Sommer 2005; zuletzt abgerufen am 10. Februar 2016.
↑ Malariaschnelltests (Memento des Originals vom 28. Februar 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.uniklinik-freiburg.de (PDF) Uni Freiburg
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.uniklinik-freiburg.de (PDF) Uni Freiburg
↑ Marianne Abele-Horn (2009), S. 215.
↑ Empfehlungen zur Prophylaxe und Therapie der Malaria der DTG 2013. Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V., 2013, abgerufen am 3. Februar 2014.
↑ Jörg Braun: Infektionskrankheiten. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 437–519, hier: S. 470.
↑ Rémy Vatan, Thierry Pistone, Pascal Millet, Gabriel Etienne, Patrick Mercié, Maïté Longy-Boursier, Denis Malvy: Analyse rétrospective de 107 cas de paludisme d’importation chez l’adulte. In: La Presse Médicale. Band 35, 4-C1. Elsevier Masson, April 2006, ISSN 0755-4982, S. 571–577, PMID 16614596.
↑ Marianne Abele-Horn (2009), S. 214.
↑ Empfehlungen zur Malariavorbeugung. (PDF) Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V., Mai 2018, abgerufen am 17. November 2018.
↑ Vgl. Roche Deutschland: Rote-Hand-Brief zu Lariam ®. (Memento vom 22. Oktober 2013 im Internet Archive) Veröffentlicht auf der Internetseite des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM), September 2013.
↑ W. Burns: East meets West: how China almost cured malaria. In: Endeavour. 32, 2008, S. 101–106, doi:10.1016/j.endeavour.2008.07.001.
↑ Nature News Blog: Protein folding and malaria meds take Laskers.
↑ Lasker Foundation: Lasker Clinical Medical Research Award – Tu Youyou.
↑ nobelprize.org: The Nobel Prize in Physiology or Medicine 2015.
↑ Essential Medicines: WHO Model List. (PDF; 422 kB) 14th Edition, 2005.
↑ Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V.: Leitlinie Diagnostik und Therapie der Malaria. (Memento vom 13. Januar 2014 im Internet Archive) (PDF) November 2013. AWMF-Leitlinien-Register 042/001.
↑ P. M. Arguin, R. Kathrine, K. R. Tan: Malaria. In: CDC Yellow Book. Centers for Disease Control, Atlanta 2014.
↑ World Health Organization: Guidelines for the treatment of malaria. 3rd ed. Genf 2015, ISBN 978-92-4154912-7 (who.int [PDF]).
↑ Marcus V G Lacerda, Alejandro Llanos-Cuentas, Srivicha Krudsood, Chanthap Lon, David L. Saunders: Single-Dose Tafenoquine to Prevent Relapse of Plasmodium vivax Malaria. In: New England Journal of Medicine. Band 380, Nr. 3, 17. Januar 2019, ISSN 0028-4793, S. 215–228, doi:10.1056/NEJMoa1710775 (nejm.org [abgerufen am 28. Februar 2019]).
↑ Justin A Green, Khadeeja Mohamed, Navin Goyal, Samia Bouhired, Azra Hussaini: Pharmacokinetic Interactions between Tafenoquine and Dihydroartemisinin-Piperaquine or Artemether-Lumefantrine in Healthy Adult Subjects. In: Antimicrobial Agents and Chemotherapy. Band 60, Nr. 12, 2016, ISSN 1098-6596, S. 7321–7332, doi:10.1128/AAC.01588-16, PMID 27697758, PMC 5119013 (freier Volltext).
↑ Marianne Abele-Horn (2009), S. 214.
↑ Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e.V.: Leitlinie: Diagnostik und Therapie der Malaria. Juli 2016. Bei Schwangeren müssen entsprechende Kontraindikationen berücksichtigt und Alternativpräparate verwendet werden.
↑ Kriterien der komplizierten Malaria: Bewusstseinsstörung, Koma, Krämpfe, Anämie, Nierenversagen, niedriger Blutdruck, Gelbsucht, Lungenödem oder Lungenversagen (ARDS), Azidose, Unterzucker, makroskopisch sichtbarer Hämoglobinurie, Hyperparasitämie. Vgl. Marianne Abele-Horn (2009), S. 214.
↑ E. Tognotti: Program to eradicate malaria in Sardinia, 1946–1950. In: Emerging infectious diseases. Band 15, Nummer 9, September 2009, S. 1460–1466, ISSN 1080-6059. doi:10.3201/eid1509.081317. PMID 19788815. PMC 2819864 (freier Volltext).
↑ B. Eskenazi, J. Chevrier u. a.: The Pine River statement: human health consequences of DDT use. In: Environmental health perspectives. Band 117, Nummer 9, September 2009, S. 1359–1367, ISSN 1552-9924. doi:10.1289/ehp.11748. PMID 19750098. PMC 2737010 (freier Volltext). (Review).
↑ U.S. Department of Health and Human Services, Agency for Toxic Substances and Disease Registry: Toxicological profile for DDT, DDE and DDD. (PDF; 4,2 MB), 2002.
↑ IARC Monographs evaluate DDT, lindane, and 2,4-D, 23. Juni 2015.
↑ India-United Nations pact to end DDT use by 2020, Deccan Herald, 26. August 2015 Abruf 30. Januar 2018
↑ Neue Hoffnung auf Malaria-Impfstoff. In: Spektrum der Wissenschaft. Nr. 5, 2005, S. 20ff.
↑ V. A. Stewart, S. M. McGrath u. a.: Priming with an adenovirus 35-circumsporozoite protein (CS) vaccine followed by RTS,S/AS01B boosting significantly improves immunogenicity to Plasmodium falciparum CS compared to that with either malaria vaccine alone. In: Infection and immunity. Band 75, Nummer 5, Mai 2007, S. 2283–2290, ISSN 0019-9567. doi:10.1128/IAI.01879-06. PMID 17307942. PMC 1865796 (freier Volltext).
↑ K. Matuschewski, A. K. Mueller: Vaccines against malaria - an update. In: The FEBS journal. Band 274, Nummer 18, September 2007, S. 4680–4687, ISSN 1742-464X. doi:10.1111/j.1742-4658.2007.05998.x. PMID 17824954. (Review).
↑ Endlich ein Malaria-Impfstoff? In: Spektrum der Wissenschaft. Nr. 1, 2006, S. 10.
↑ F.A.Z.: Hoffnung im Kampf gegen Malaria. In: FAZ.net. 16. Januar 2010, abgerufen am 27. Dezember 2014.
↑ S. T. Agnandji, B. Lell u. a.: First results of phase 3 trial of RTS,S/AS01 malaria vaccine in African children. In: The New England Journal of Medicine. Band 365, Nummer 20, November 2011, S. 1863–1875, ISSN 1533-4406. doi:10.1056/NEJMoa1102287. PMID 22007715.
↑ Positive Studienergebnisse zu möglichem Malaria-Impfstoff für Kinder. (Nicht mehr online verfügbar.) GlaxoSmithKline, 8. Oktober 2013, archiviert vom Original am 9. April 2014; abgerufen am 24. Juli 2014 (Pressemitteilung). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.glaxosmithkline.de
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.glaxosmithkline.de
↑ GSK announces EU regulatory submission for malaria vaccine candidate RTS,S. (Nicht mehr online verfügbar.) GlaxoSmithKline, 24. Juli 2014, archiviert vom Original am 20. Februar 2015; abgerufen am 20. Februar 2015 (englisch, Pressemitteilung). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.gsk.com
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.gsk.com
↑ Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. In: RTS,S Clinical Trials Partnership (Hrsg.): Lancet. 23. April 2015 (englisch, thelancet.com).
↑ Vasee S Moorthyemail, Jean-Marie Okwo-Bele: Final results from a pivotal phase 3 malaria vaccine trial. In: Lancet. 23. April 2015, doi:10.1016/S0140-6736(15)60767-X (englisch). , zitiert nach Alina Schadwinkel: Der erste Impfstoff gegen Malaria kommt. Zeit Online, 24. April 2015; abgerufen 25. April 2015
↑ Experiment mit Mäusen: Impfung macht Malariaerreger aggressiver. In: Spiegel Online. 1. August 2012, abgerufen am 27. Dezember 2014.
↑ Endlich ein Impfstoff? Anti-Malaria-Serum senkt Erkrankungsrate. n-tv, 8. August 2013, abgerufen am 7. Dezember 2013.
↑ Protection Against Malaria by Intravenous Immunization with a Nonreplicating Sporozoite Vaccine. In: Science. Abgerufen am 7. Dezember 2013.
↑ wissenschaft.de: Eingeimpfter Fortpflanzungsstopp (Memento des Originals vom 30. März 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.wissenschaft.de vom 26. März 2008.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.wissenschaft.de vom 26. März 2008.
↑ Y. Liu, R. Tewari u. a.: The conserved plant sterility gene HAP2 functions after attachment of fusogenic membranes in Chlamydomonas and Plasmodium gametes. In: Genes & development. Band 22, Nummer 8, April 2008, S. 1051–1068, ISSN 0890-9369. doi:10.1101/gad.1656508. PMID 18367645. PMC 2335326 (freier Volltext).
↑ Neue Perspektive für den Kampf gegen die Malaria. Universitätsklinikum Heidelberg, 30. Oktober 2002.
↑ R. H. Schirmer, B. Coulibaly u. a.: Methylene blue as an antimalarial agent. In: Redox report: communications in free radical research. Band 8, Nummer 5, 2003, S. 272–275, ISSN 1351-0002. doi:10.1179/135100003225002899. PMID 14962363. (Review).
↑ Malaria Atlas Projekt
↑ S. Wang, A. K. Ghosh u. a.: Fighting malaria with engineered symbiotic bacteria from vector mosquitoes. In: Proceedings of the National Academy of Sciences. Band 109, Nummer 31, Juli 2012, S. 12734–12739. doi:10.1073/pnas.1204158109. PMID 22802646.
↑ Hoffnung auf Impfstoff: Neu entdeckter Antikörper schützt vor Malaria. In: Spiegel Online - Wissenschaft. 23. Mai 2014, abgerufen am 24. Juni 2014.
↑ D. K. Raj, C. P. Nixon u. a.: Antibodies to PfSEA-1 block parasite egress from RBCs and protect against malaria infection. In: Science. Band 344, Nummer 6186, Mai 2014, S. 871–877, ISSN 1095-9203. doi:10.1126/science.1254417. PMID 24855263. PMC 4184151 (freier Volltext).
↑ Malaria: Vakzine aus Tetrahymena entwickelt. In: aerztezeitung.de. 10. März 2014, abgerufen am 10. Juni 2014.
↑ Impfstoffentwicklung: Neue Waffe gegen Malaria. In: Focus.de. 1. März 2014, abgerufen am 10. Juni 2014.
↑ N. J. White, S. Pukrittayakamee u. a.: Spiroindolone KAE609 for falciparum and vivax malaria. In: The New England Journal of Medicine. Band 371, Nummer 5, Juli 2014, S. 403–410, ISSN 1533-4406. doi:10.1056/NEJMoa1315860. PMID 25075833. PMC 4143746 (freier Volltext).
↑ Alexander L. Perryman: GO Fight Against Malaria update: promising early findings for malaria & drug-resistant tuberculosis. 14. Juli 2014, abgerufen am 20. Februar 2015.
↑ Alexander L. Perryman u. a.: A Virtual Screen Discovers Novel, Fragment-Sized Inhibitors of Mycobacterium tuberculosis InhA. In: J. Chem. Inf. Model. 30. Januar 2015, doi:10.1021/ci500672v.
↑ Ailie Robinson et al.: Plasmodium-associated changes in human odor attract mosquitoes. In: PNAS. Online-Vorabveröffentlichung vom 16. April 2018, doi:10.1073/pnas.1721610115
Malaria infection creates a ‘human perfume’ that makes us more attractive to mosquitoes. Auf: sciencemag.org vom 26. April 2018, doi:10.1126/science.aat8993
↑ Consuelo M. De Moraes et al.: Malaria-induced changes in host odors enhance mosquito attraction. In: PNAS. Band 111, Nr. 30, 2015, S. 11079–11084, doi:10.1073/pnas.1405617111
↑ Renaud Lacroix et al.: Malaria Infection Increases Attractiveness of Humans to Mosquitoes. In: PLoS Biology. Online-Publikation vom 9. August 2005, doi:10.1371/journal.pbio.0030298
↑ Norbert Blüm: Ich stelle mir die CDU anders vor. In: Süddeutsche Zeitung. 7. Oktober 2003, abgerufen am 3. Februar 2014.
↑ Kampf den armutsbedingten Krankheiten: Kommissionsmitglied Philippe Busquin besucht Afrika und stellt das Programm für klinische Versuche vor. EU-Kommission, 31. Juli 2003, abgerufen am 3. Februar 2014 (Pressemitteilung).
↑ Paul Prociv: Malaria Vaccine: Salvation for the World? (PDF) (Nicht mehr online verfügbar.) In: The Skeptic. 2005, S. 58, archiviert vom Original am 14. Februar 2014; abgerufen am 3. Februar 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.skeptics.com.au
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.skeptics.com.au
↑ Bill Gates will mit $ 258 Mio Malaria bekämpfen. 31. Oktober 2005, archiviert vom Original am 12. Januar 2006; abgerufen am 3. Februar 2014.
↑ J. Sachs, P. Malaney: The economic and social burden of malaria. In: Nature. Band 415, Nummer 6872, Februar 2002, S. 680–685, ISSN 0028-0836. doi:10.1038/415680a. PMID 11832956. (Review).
↑ B. M. Greenwood, K. Bojang u. a.: Malaria. In: Lancet. Band 365, Nummer 9469, 2005 Apr 23-29, S. 1487–1498, ISSN 1474-547X. doi:10.1016/S0140-6736(05)66420-3. PMID 15850634. (Review).
↑ Malaria bei den Alten Ägyptern. In: Epoc. Das Magazin für Archäologie und Geschichte. Band 1, Nummer 10, Spektrum, Heidelberg 2009, ISSN 1865-5718, nach: Discovery chanal 8.2008.
↑ Gundolf Keil: Fieberlehre. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 398–400, hier: S. 398 (Hippokratiker).
↑ Gundolf Keil (2005), S. 399 f. (Galen).
↑ Johann Hermann Baas: Die geschichtliche Entwicklung des ärztlichen Standes und der medicinischen Wissenschaften. Leipzig 1896, S. 99.
↑ Renate Wittern: Die Wechselfieber bei Galen. In: Hist. Phil. Life Sci. Band 11, Nr. 1, 1989, S. 3–22, JSTOR:23330279.
↑ Barbara I. Tshisuaka: Ingrassias, Giovanni Filippo. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/New York 2005, ISBN 3-11-015714-4, S. 673.
↑ Manfred Vasold: Die Sterblichkeit in Nürnberg im 19. Jahrhundert. Lebensumstände, Krankheit und Tod (um 1800 bis 1913). In: Würzburger medizinhistorische Mitteilungen. Band 25, 2006, S. 241–338, hier: S. 279 f.
↑ David George Haskell: The forest unseen: a year’s watch in nature. Viking, New York 2012, ISBN 978-0-670-02337-0, S. 111.
↑ Markus Brauer: Medizin-Nobelpreis 2015 für drei Parasitenforscher. Kampf gegen Geißeln der Menschheit. Auf: stuttgarter-nachrichten.de vom 5. Oktober 2015, abgerufen am 7. Oktober 2015.
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |